
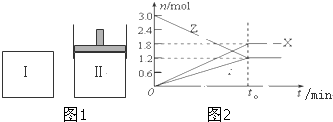
| A、该反应的化学方程式为:3X+2Y?2Z |
| B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 |
| C、两容器中均达到平衡时,Z的物质的量分数相同 |
| D、达平衡后,V(x)为1.8/t0 mol/(L?min) |
| ||
| △t |


科目:高中化学 来源: 题型:
| A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B、目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C、2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料 |
| D、合成高分子材料的广泛应用是有百利而无一害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
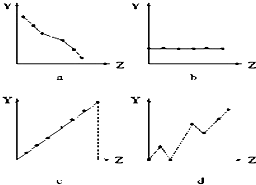 (1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol A和1molB |
| B、2molC |
| C、3mol A和3molB |
| D、1molB和2molC |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
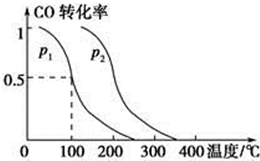 面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com