
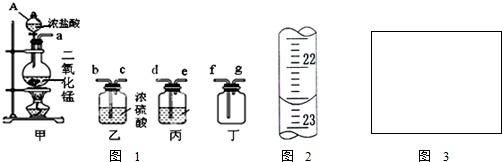
| ||
| ||
| ||
 ,故答案为:
,故答案为: .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、若有l mol NO3-参加还原反应,则转移8mol e- |
| B、还原产物为NH4+ |
| C、氧化剂与还原剂的物质的量之比为8:l |
| D、若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校研究性学习小组就氮及其化合物展开研究.
某校研究性学习小组就氮及其化合物展开研究.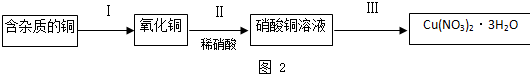
| ||
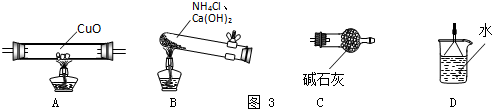
查看答案和解析>>
科目:高中化学 来源: 题型:
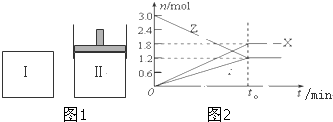
| A、该反应的化学方程式为:3X+2Y?2Z |
| B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 |
| C、两容器中均达到平衡时,Z的物质的量分数相同 |
| D、达平衡后,V(x)为1.8/t0 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104s1, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.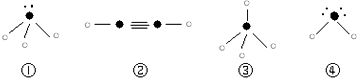
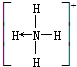 (→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式
(→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛有NO2和N2O4 混合气体的烧瓶置于热水中,气体颜色变深 |
| B、工业合成氨选择500℃左右的温度比室温有利 |
| C、实验室中常用排饱和食盐水的方法收集Cl2 |
| D、合成氨时采用循环操作及将氨液化分离,可提高原料的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com