
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、X2YZ3 |
| B、X2YZ2 |
| C、X3YZ3 |
| D、XYZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| O3,Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
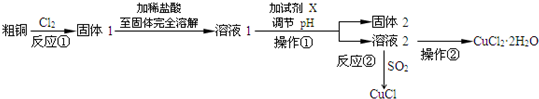
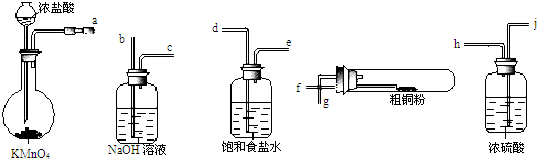
查看答案和解析>>
科目:高中化学 来源: 题型:
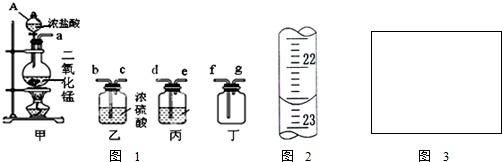
查看答案和解析>>
科目:高中化学 来源: 题型:
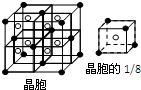 A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:
A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、灰霾主要由PM2.5组成 |
| B、PM2.5颗粒直径小,表面积大,吸附能力强,吸附有毒物会增强它的毒性 |
| C、目前我国空气污染指数(API)指标数值范围只包含二氧化硫(SO2)、二氧化氮(NO2)和可吸入颗粒物(PM10)三个指标 |
| D、PM10为可吸入性颗粒,将其纳入空气污染指数(API),是因为其危害比PM2.5更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以上四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 |
| B、若R的含氧酸的酸性强于Q的含氧酸的酸性,则非金属性R强于Q |
| C、碳、钠与O2反应时,由于O2的量不同,可分别生成CO、CO2和Na2O、Na2O2 |
| D、所有的酸酐都是氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com