
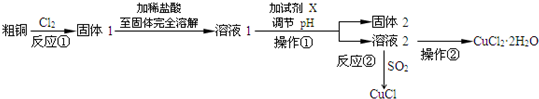
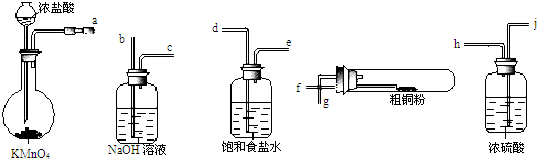
| ||
| ||


科目:高中化学 来源: 题型:
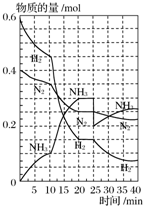 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A、从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol?L-1?min-1 |
| B、平衡在10 min至20 min的变化,可能是因为增大了容器体积 |
| C、25 min时,分离出了0.1 mol NH3 |
| D、在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性强于Y的非金属性 |
| W | W的一种核素的质量数为63,中子数为34 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解质在水中一定能导电 |
| B、纯水的导电性很差,所以水不是电解质 |
| C、溶液导电性的强弱取决于溶液中离子浓度及所带电荷的多少 |
| D、NaCl溶液在电流作用下电离成Na+与Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
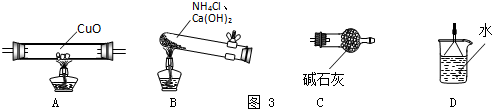
 某校研究性学习小组就氮及其化合物展开研究.
某校研究性学习小组就氮及其化合物展开研究.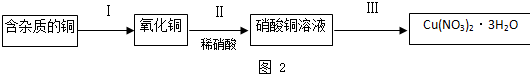
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池反应是自发的氧化还原反应,盐桥的作用是平衡正负极电荷,形成闭合回路 |
| B、为防止轮船发生腐蚀,往往在轮船外壳焊上金属锌,这是牺牲阴极的阳极保护法 |
| C、精炼铜时,粗铜做阳极,纯铜做阴极,CuSO4是电解质溶液,电解前后溶液浓度不变 |
| D、电镀是特殊的电解,电解前后阴极减少的质量与阳极增加的质量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com