
| A、原电池反应是自发的氧化还原反应,盐桥的作用是平衡正负极电荷,形成闭合回路 |
| B、为防止轮船发生腐蚀,往往在轮船外壳焊上金属锌,这是牺牲阴极的阳极保护法 |
| C、精炼铜时,粗铜做阳极,纯铜做阴极,CuSO4是电解质溶液,电解前后溶液浓度不变 |
| D、电镀是特殊的电解,电解前后阴极减少的质量与阳极增加的质量相等 |


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
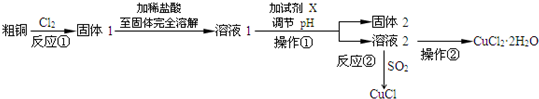
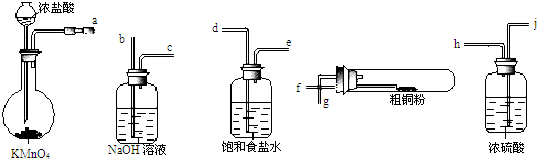
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以上四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
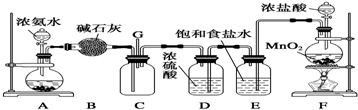
查看答案和解析>>
科目:高中化学 来源: 题型:
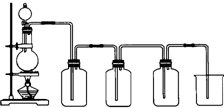 已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.
已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.| 实验方法 | 实验现象 | 结论 |
| 第一组:分别向A、B溶液中加KSCN溶液 | 固体物质中含有FeCl3 | |
| 第二组:分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 |
| B、若R的含氧酸的酸性强于Q的含氧酸的酸性,则非金属性R强于Q |
| C、碳、钠与O2反应时,由于O2的量不同,可分别生成CO、CO2和Na2O、Na2O2 |
| D、所有的酸酐都是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量金属钾应保存在水中 |
| B、用萃取的方法可除去水中的Cl- |
| C、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| D、读取滴定管内液体的体积,俯视读数导致读数偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com