
| A、以上四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性强于Y的非金属性 |
| W | W的一种核素的质量数为63,中子数为34 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104s1, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.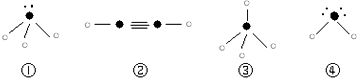
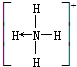 (→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式
(→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 操作 |
| A | 配置100ml1.0mol/CuSO4溶液 | 将25gCuSO4.5H2O溶于100ml蒸馏水是 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 检验溶液中是否存在Fe3+ | 去少量溶液滴加硫氰化钾溶液 |
| D | 除去Na2CO3溶液中的少量NaHCO3 | 去混合物加入适量氢氧化钠溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池反应是自发的氧化还原反应,盐桥的作用是平衡正负极电荷,形成闭合回路 |
| B、为防止轮船发生腐蚀,往往在轮船外壳焊上金属锌,这是牺牲阴极的阳极保护法 |
| C、精炼铜时,粗铜做阳极,纯铜做阴极,CuSO4是电解质溶液,电解前后溶液浓度不变 |
| D、电镀是特殊的电解,电解前后阴极减少的质量与阳极增加的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、①③⑥ |
| C、②④⑤ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com