


科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
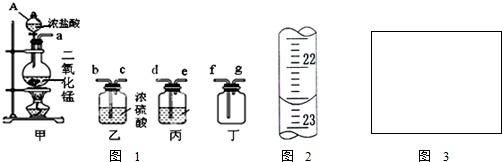
查看答案和解析>>
科目:高中化学 来源: 题型:
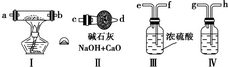
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、灰霾主要由PM2.5组成 |
| B、PM2.5颗粒直径小,表面积大,吸附能力强,吸附有毒物会增强它的毒性 |
| C、目前我国空气污染指数(API)指标数值范围只包含二氧化硫(SO2)、二氧化氮(NO2)和可吸入颗粒物(PM10)三个指标 |
| D、PM10为可吸入性颗粒,将其纳入空气污染指数(API),是因为其危害比PM2.5更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
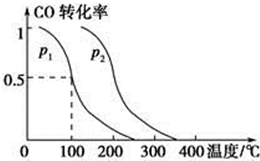 面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com