
(1)C2H4O (2)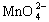 (3)Na2O2 (4)Ca(ClO)2
(3)Na2O2 (4)Ca(ClO)2
解析:在化合物中,通常氧是-2价,氢是+1价,根据化合物中正负化合价代数和为0的原则,可求出其他元素的化合价。
(1)设C2H4O中C元素的化合价为x,则![]() 2
2![]() 4
4![]()
2x+1×4+(-2)×1=0 x=-1
(2)设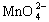 中Mn元素的化合价为x,则
中Mn元素的化合价为x,则![]()
x+(-2)×1=-2 x=+6
(3)如果根据O元素的化合价为-2价,则求出Na2O2中Na元素为+2价,而Na原子的最外层只有1个电子,失去2个电子显然不可能,故认为化合物中Na元素只有一种化合价:+1价,设Na2O2中O元素的化合价为x,则![]()
+1×2+x×2=0 x=-1
(4)设Ca(ClO)2中Cl元素的化合价为x,则![]()
+2+(x-2×2)×2=0 x=+1
![]()


科目:高中化学 来源: 题型:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |

| ||
| ||


 的电子式
的电子式

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源:2014届浙江省杭州市七校高三上学期期中联考化学试卷(解析版) 题型:填空题
(1)已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。

①a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
②前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。反应在第一个平衡点的平衡常数K(1)= (可用分数表示)。反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”)。
③请在右图坐标中画出1 mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。

(2)右图中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图。试回答下列问题:

①请你归纳:非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系 。
②写出硒化氢发生分解反应的热化学反应方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com