
【题目】在“绿色化学”工艺中,理想状态是反应物中的原子全能转化目标产物,即原子利用率为100%。在下列反应类型中,不能体现这一原子最经济性原则的是
A. 化合反应 B. 加聚反应 C. 加成反应 D. 消去反应
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】完成下反应的化学方祝式或离子方程式:
(1)铝与黑色铁的化合物(有磁性)反应_____________。
(2)工业上制粗硅的反应____________。
(3)硫酸铝溶液中加入过量氨水的离子方程式____________。
(4)用稀盐酸清洗铜器皿表面上的铜锈的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g) ![]() z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x + y < z B.B的转化率降低
C.平衡向正反应方向移动 D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可用来衡量一个国家的石油化工发展水平。下列关于乙烯的说法正确的是
A. 与苯互为同分异构体
B. 分子中存在碳碳双键
C. 能使溴的四氯化碳溶液褪色
D. 能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
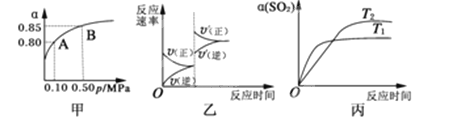
A. 由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B. 由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上的电子数是原子核外电子层数的2倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)Y形成的双原子分子中的化学键为_____________(填“极性键”或“非极性键”)。
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Y与氢元素形成一种分子YH3,写出该粒子的电子式:________。
(4)元素Z与元素T相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是________________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是4种短周期元素,在元素周期表中的位置如下图所示,其中Z位于ⅦA族。下列判断错误的是( )
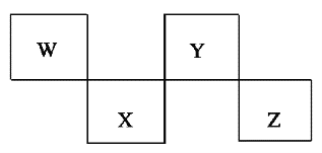
A. 常压下四种元素的单质中,W单质的熔点最高 B. Z的阴离子电子层结构与氩原子的相同
C. W的氢化物的沸点比Y的氢化物的沸点高 D. Y元素的非金属性比X元素的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com