
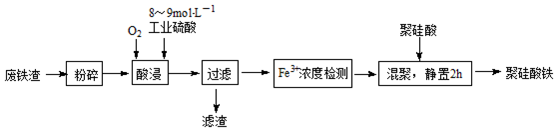

分析 (1)为了使原料充分反应,粉碎废铁渣;
(2)①Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁;
②溶液中有亚铁离子,氧气可将亚铁离子氧化为铁离子;
③考虑温度对铁离子的水解的影响;
(3)碳和二氧化硅不溶于稀硫酸;
(4)已知:在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),则亚铁离子被氧化为铁离子,再根据得失电子守恒和原子守恒可得.
解答 解:(1)对废铁渣进行粉碎的目的:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率;
故答案为:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率;
(2)①加热条件下酸浸时,Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁,方程式为:Fe3O4+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4+Fe2(SO4)3+4H2O;
故答案为:Fe3O4+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4+Fe2(SO4)3+4H2O;
②酸浸时有亚铁离子生成,通入氧气能将亚铁离子氧化为铁离子;
故答案为:将FeSO4氧化为Fe2(SO4)3;
③铁离子在水溶液中存在水解,温度升高有利于水解反应的进行,温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低;
故答案为:温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低;
(3)废铁渣(主要成分Fe3O4,少量碳及二氧化硅),酸浸,碳与二氧化硅不溶于稀硫酸也不反应,故滤渣的主要成分问碳和二氧化硅;
故答案为:C和SiO2;
(4)在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),则亚铁离子被氧化为铁离子,发生的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O.
点评 本题是制备工艺流程图的考查,涉及了氧化还原反应离子方程式的书写,铁的有关物质的性质,题目难度不大,掌握基础是关键.


科目:高中化学 来源: 题型:选择题
| A. | 将过量的Na投入到AlCl3溶液中 | B. | 将过量的Al投入到NaOH溶液中 | ||
| C. | 将过量的Na投入到MgCl2溶液中 | D. | 将过量的Na2O2投入到FeCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
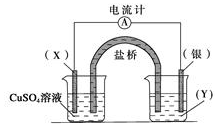 依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示.
依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 纯碱 | 硫酸 | 小苏打 | 氧化钙 | 干冰 |
| B | 烧碱 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 石灰水 | NaHSO4 | 碳酸钙 | 过氧化钠 | 二氧化碳 |
| D | NH3•H2O | HNO3 | 明矾 | 氧化铁 | SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、CO32-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | K+、Na+、OH-、SO42- | D. | Na+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | CH3COOH溶液与NH3•H2O溶液反应:H++OH-═H2O | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com