
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 硫化钠的水解反应:S2-+2H2O?H2S+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-═Cu2++2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | l L pH=l的硫酸溶液中含有的H+ 数为0.2NA | |
| C. | 78 g Na202固体中含有的阴离子数为2NA | |
| D. | 500 mL 2 mol.L-l FeCl2溶液中Fe3+数为NA,且$\frac{n(C{l}^{-})}{n(F{e}^{3+})}$=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Na2O2 | C. | CuO | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要摄入反式脂肪酸,就一定会患上心血管疾病 | |
| B. | 氢化是一种把液态植物油转化成固态或半固态脂肪的化学工艺 | |
| C. | 奶油、代可可脂巧克力、乳饮料、奶茶、蛋黄派等零食都可能含有反式脂肪酸 | |
| D. | 食品标签里的氢化植物油、植脂末、起酥油、代可可脂等都可能是反式脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
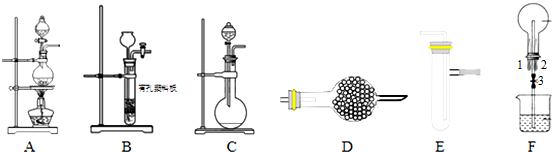
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
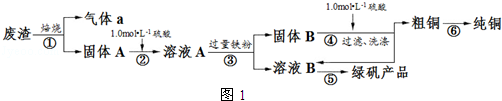
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
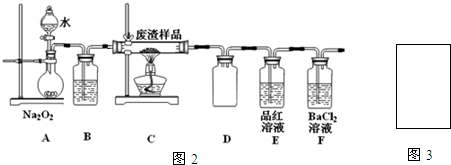
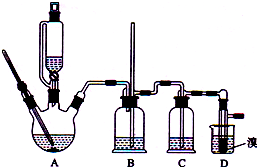 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com