
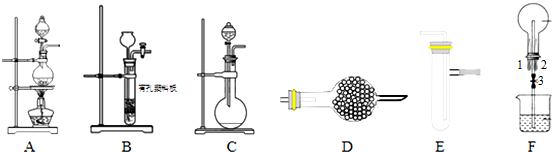
分析 (1)实验中干燥氨气可以用碱石灰或生石灰;
(2)依据制备氯气装置是利用二氧化锰和浓盐酸加热反应,生成的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;
(3)实验时打开开关1、3,关闭2向烧瓶中通入氯气,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的氨气,实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,依据反应化学方程式判断是生成的氯化氢和氨气反应生成的氯化铵;依据铵根离子的检验方法是和碱反应生成氨气设计实验检验;
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,氯气通入溴化钠溶液中,氯气氧化溴离子为溴单质,溶液呈橙红色;若利用装置A、E进行乙烯与溴水反应的实验,乙烯制备需要控制反应温度170°C,实验装置中需要用温度计控制反应液的温度;
(5)将装置B、C分别与F相连后,进行H2S与SO2反应的实验,B是制备硫化氢气体的发生装置,C是二氧化硫气体制备的装置,通入F中二氧化硫氧化硫化氢生成硫单质,容器中压强减小,会产生倒吸,同时F烧杯可以吸收剩余气体二氧化硫或硫化氢有毒气体.
解答 解:Ⅰ、(1)实验中干燥氨气可以用碱石灰或生石灰,故选ad;
(2)依据制备氯气装置是利用二氧化锰和浓盐酸加热反应,生成的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;
故答案为:饱和食盐水、浓硫酸;
(3)实验时打开开关1、3,关闭2向烧瓶中通入氯气,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的氨气,实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,已知氯气与氨气可发生反应:3Cl2+2NH3→N2+6HCl,依据反应化学方程式判断是生成的氯化氢和过量氨气反应生成的氯化铵;铵根离子的检验方法是,取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;
故答案为:氯气;取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,氯气通入溴化钠溶液中,氯气氧化溴离子为溴单质,反应为:Cl2+2NaBr=Br2+2NaCl,溴单质溶于水溶液呈橙红色;若利用装置A、E进行乙烯与溴水反应的实验,装置A是乙烯制备装置,需要控制反应温度170°C,实验装置中需要用温度计控制反应液的温度,所以要将分液漏斗改为温度计,并使温度计水银球没入烧瓶内液面下;
故答案为:装置E中的NaBr溶液变橙红色;将分液漏斗改为温度计,并使温度计水银球没入烧瓶内液面下;
(5)将装置B、C分别与F相连后,进行H2S与SO2反应的实验,B是制备硫化氢气体的发生装置,C是二氧化硫气体制备的装置,通入F中二氧化硫氧化硫化氢生成硫单质,容器中压强减小,会产生倒吸,同时F烧杯可以吸收剩余气体二氧化硫或硫化氢有毒气体;
故答案为:证明烧瓶中压强减少,同时吸收剩余气体二氧化硫或硫化氢有毒气体.
点评 本题考查物质性质的实验验证和实验设计方法,反应现象的分析判断,装置选择,掌握实验基础和物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
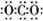 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 化学式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF溶液保存在玻璃试剂瓶中 | |
| B. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| C. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ②
②
 (请用化学方程式表达).
(请用化学方程式表达). 等(任写一种).
等(任写一种).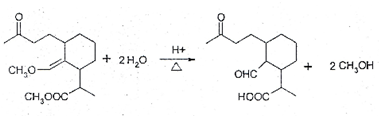 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
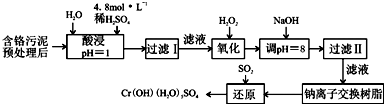
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
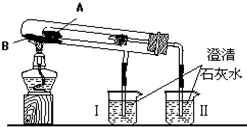
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com