
【题目】磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.
(1)基态铜原子的电子排布式为;价电子中成对电子数有个.
(2)磷化铜与水作用产生有毒的磷化氢(PH3). ①PH3分子中的中心原子的杂化方式是 .
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由: .
(3)磷青铜中的锡、磷两元素电负性的大小为SnP(填“>”“<”或“=”).
(4)某磷青铜晶胞结构如图所示. 
①则其化学式为 .
②该晶体中距离Cu原子最近的Sn原子有个,这些Sn原子所呈现的构型为 .
③若晶体密度为8.82g/cm3 , 最近的Cu原子核间距为pm(用含NA的代数式表示).
【答案】
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1;10
(2)sp3;>;因为HNO3分子结构中含有2个非烃基氧原子,比H3PO4中多1个
(3)<
(4)SnCu3P;4;平面正方形;![]() ×
× ![]() ×1010
×1010
【解析】解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1 , 铜原子价电子3d104s1 , 其中成对电子数10个, 所以答案是:1s22s22p63s23p63d104s1或[Ar]3d104s1;10;(2)①.PH3分子中价层电子对个数=σ键个P数+孤电子对个数=3+ ![]() (5﹣3×1)=4,所以磷原子采用sp3杂化,所以答案是:sp3;②非金属性N>P,对应最高价氧化物对应的水化物的酸性为HNO3>H3PO4 , 从结构的角度因为HNO3分子结构中含有2个非烃基氧原子,比H3PO4中多1个,酸性为HNO3>H3PO4 , 所以答案是:>;因为HNO3分子结构中含有2个非烃基氧原子,比H3PO4中多1个;(3)磷青铜中的锡、磷两元素电负性的大小为Sn<P,所以答案是:<;(4)①
(5﹣3×1)=4,所以磷原子采用sp3杂化,所以答案是:sp3;②非金属性N>P,对应最高价氧化物对应的水化物的酸性为HNO3>H3PO4 , 从结构的角度因为HNO3分子结构中含有2个非烃基氧原子,比H3PO4中多1个,酸性为HNO3>H3PO4 , 所以答案是:>;因为HNO3分子结构中含有2个非烃基氧原子,比H3PO4中多1个;(3)磷青铜中的锡、磷两元素电负性的大小为Sn<P,所以答案是:<;(4)① 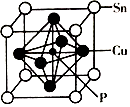 ,晶体中P原子位于中心,含有一个磷原子,立方体每个面心喊一个Cu,每个Cu分摊给一个晶胞的占
,晶体中P原子位于中心,含有一个磷原子,立方体每个面心喊一个Cu,每个Cu分摊给一个晶胞的占 ![]() ,立方体顶角Sn分摊给每个晶胞的原子为
,立方体顶角Sn分摊给每个晶胞的原子为 ![]() ,据此得到化学式SnCu3P,
,据此得到化学式SnCu3P,
所以答案是:SnCu3P;②该晶体中距离Cu原子最近的Sn原子有4个,这些Sn原子所呈现的构型为平面正方形,所以答案是:4;平面正方形;③摩尔质量=342g/mol,则一个晶胞质量 ![]() g,设立方体边长为x,铜原子间最近距离为a,则a2=(
g,设立方体边长为x,铜原子间最近距离为a,则a2=( ![]() )2+(
)2+( ![]() )2 , a=
)2 , a= ![]() x,结合密度ρ=
x,结合密度ρ= ![]() ,V=x3=
,V=x3= 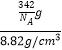 =
= ![]() cm3 , x=
cm3 , x= ![]() cm,a=
cm,a= ![]() x=
x= ![]() ×
× ![]() cm═
cm═ ![]() ×
× ![]() ×1010pm,所以答案是:
×1010pm,所以答案是: ![]() ×
× ![]() ×1010 .
×1010 .


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A,B,C,D,E点,下列有关说法正确的是( ) 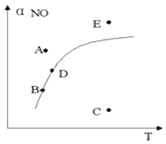
A.A点反应未达到平衡状态,且反应正向移动
B.C点NO转化率最低,且化学反应速率最小
C.B,D两点均处于相应温度下的化学平衡状态,且αB(NO)<αD(NO)
D.E点反应未达平衡,反应正向移动,容器类压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | KCl溶液 | I2 | CCl4,萃取 |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Fe | Cu | 稀硫酸,过滤 |
D | CaCO3 | CaO | 稀盐酸,过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造.以镍粉废料为原料制备Ni2O3的工艺如图1 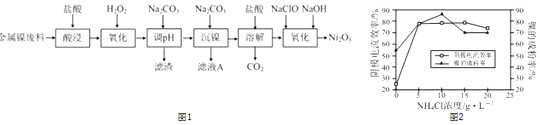
回答下列问题:
(1)Ni2O3中Ni的化合价为 .
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是 .
(3)加入H2O2“氧化”的离子方程式为;滤渣A的主要成分是(填化学式).
(4)工艺中分步加入Na2CO3的作用是;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为 .
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉.当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图2所示: ①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(g)pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的 ![]() ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
A.m+n>p
B.平衡向逆反应方向移动
C.A的转化率提高
D.C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy , 则( ) 
A.x为弱酸,Vx<Vy
B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy
D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将4molPCl3和2molCl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2PCl5 , 各物质均为气态.达平衡后,PCl5为0.8mol.若此时再移走2molPCl3和1molCl2 , 相同温度下达到平衡,PCl5的物质的量为( )
A.0.8mol
B.0.4mol
C.0.4mol<x<0.8mol
D.<0.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com