
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是

A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
【答案】C
【解析】
根据图示,不锈钢电极为阴极,阴极上发生还原反应,电解质溶液中阳离子得电子,电极反应为:Mn2++2e-= Mn;钛土电极为阳极,锰离子失去电子转化为二氧化锰,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,据此解题。
A.根据分析,阴极电极反应为:Mn2++2e-= Mn,阳极电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,阴极区的SO42-通过交换膜进入阳极区,因此阳极上有MnO2析出,阳极区得到H2SO4,故A正确;
B.根据分析,阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+,故B正确;
C.由A项分析,阴极区的SO42-通过交换膜进入阳极区,则离子交换膜为阴离子交换膜,故C错误;
D.阴极电极反应为:Mn2++2e-= Mn,当电路中有2mole-转移时,阴极生成1mol Mn,其质量为1mol ×55g/mol=55g,故D正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列有关叙述正确的是( )
①1mol苯中含有的碳碳双键数为3NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N﹣H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
A. ①④⑤⑦ B. ②⑤⑧ C. ②④⑤⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用.
(1)二氧化铈![]() 是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用.
是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用.![]() 在稀硫酸和
在稀硫酸和![]() 的作用下可生成
的作用下可生成![]() ,
,![]() 在该反应中作 ______
在该反应中作 ______ ![]() 填“氧化”“还原”
填“氧化”“还原”![]() 剂,每有1mol
剂,每有1mol![]() 参加反应,转移电子的物质的量为 ______ .
参加反应,转移电子的物质的量为 ______ .
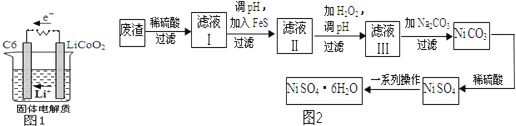
(2)某锂离子电池含![]() 导电固体为电解质.充电时,
导电固体为电解质.充电时,![]() 还原为Li,并以原子形式嵌入电极材料碳
还原为Li,并以原子形式嵌入电极材料碳![]() 中,以
中,以![]() 表示,电池反应为
表示,电池反应为![]() 则放电时,电池的正极反应式为 ______ ,图1表示该装置工作时电子和离子的移动方向,此时该电池处于 ______
则放电时,电池的正极反应式为 ______ ,图1表示该装置工作时电子和离子的移动方向,此时该电池处于 ______ ![]() 填“放电”或“充电”
填“放电”或“充电”![]() 状态.
状态.
(3)自然界Cr主要以三价Cr和六价Cr的形式存在.六价Cr能引起细胞的突变和癌变.可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式: ______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______ ,_____________
______ ,_____________
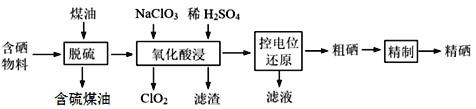
(4)![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣![]() 除含镍外,还含有Cu
除含镍外,还含有Cu![]() 为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去
为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
②向滤液Ⅱ中加入![]() ,溶液中发生反应的离子方程式为 ______ ,调节pH的目的是 ______ .
,溶液中发生反应的离子方程式为 ______ ,调节pH的目的是 ______ .
③滤液Ⅲ溶质的主要成分是![]() ,再加入碳酸钠过滤后,加稀硫酸溶解又生成
,再加入碳酸钠过滤后,加稀硫酸溶解又生成![]() 的目的是 ______ .
的目的是 ______ .
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作 ______ 极.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,有下列五种溶液:
①0.1 mol/L NH4Cl
②0.1 mol/L CH3COONH4
③0.1 mol/L NH4HSO4
④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液
⑤0.1 mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈_____性(填“酸”“碱”或“中”),其原因是____________(用离子方程式表示)。
(2)溶液①②③⑤中c(NH4+)的关系由大到小排列是______。(用①②③⑤表示)
(3)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-)________c(NH4+)(填“>”“<”或“=”)。
(4)已知室温下NH3·H2O的电离常数为1.8×10-5,通过计算可推知溶液④呈____性(填“酸”“碱”或“中”),溶液中离子浓度由小到大为____________(用离子符号表示),该温度下1 mol·L-1的NH4Cl溶液中c(H+)=_____ mol·L-1。(已知![]() ≈2.36),
≈2.36),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
回答下列问题:
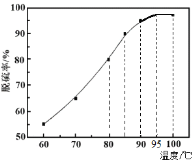
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。
(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为_____________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。
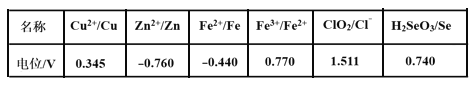
①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(S2-)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为________ %,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是

A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 、
、![]() 、
、![]() 等的处理方法对环境保护有重要意义。
等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成![]() 和
和![]() ,其反应为:
,其反应为:![]()
![]()
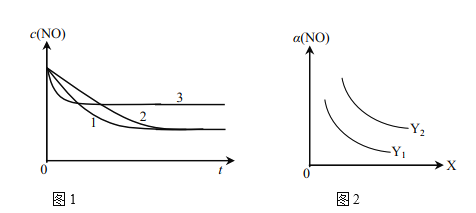
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验温度NO初始浓度O初始浓度催化剂比表面积催化剂用量编号(℃)
实验 编号 | 温度 (℃) | NO初始浓度
| CO初始浓度
| 催化剂比表面积
| 催化剂用量 (g) |
Ⅰ | 280 |
|
| 82 | 50 |
Ⅱ | 280 |
|
| 124 | 50 |
Ⅲ | 350 |
|
| 124 | 50 |
②图2表示NO的平衡转化率(a)随温度、压强变化的示意图。X表示的是________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应
以体积比1:2置于密闭容器中发生反应![]() ,达到平衡时
,达到平衡时![]() 的体积分数为25%。该反应的平衡常数
的体积分数为25%。该反应的平衡常数![]() ________。
________。
(3)利用原电池反应可实现![]() 的无害化,总反应为
的无害化,总反应为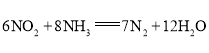 ,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有主族元素X、Y、Z,X原子的最外层电子排布式为![]() ,Y原子M能层的p能级上有4个电子,Z原子的最外层p能级上也有4个电子,且Z原子的核外电子比Y原子少8个。由这三种元素组成的化合物不可能是
,Y原子M能层的p能级上有4个电子,Z原子的最外层p能级上也有4个电子,且Z原子的核外电子比Y原子少8个。由这三种元素组成的化合物不可能是![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com