
【题目】镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用.
(1)二氧化铈![]() 是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用.
是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用.![]() 在稀硫酸和
在稀硫酸和![]() 的作用下可生成
的作用下可生成![]() ,
,![]() 在该反应中作 ______
在该反应中作 ______ ![]() 填“氧化”“还原”
填“氧化”“还原”![]() 剂,每有1mol
剂,每有1mol![]() 参加反应,转移电子的物质的量为 ______ .
参加反应,转移电子的物质的量为 ______ .
(2)某锂离子电池含![]() 导电固体为电解质.充电时,
导电固体为电解质.充电时,![]() 还原为Li,并以原子形式嵌入电极材料碳
还原为Li,并以原子形式嵌入电极材料碳![]() 中,以
中,以![]() 表示,电池反应为
表示,电池反应为![]() 则放电时,电池的正极反应式为 ______ ,图1表示该装置工作时电子和离子的移动方向,此时该电池处于 ______
则放电时,电池的正极反应式为 ______ ,图1表示该装置工作时电子和离子的移动方向,此时该电池处于 ______ ![]() 填“放电”或“充电”
填“放电”或“充电”![]() 状态.
状态.
(3)自然界Cr主要以三价Cr和六价Cr的形式存在.六价Cr能引起细胞的突变和癌变.可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式: ______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______ ,_____________
______ ,_____________
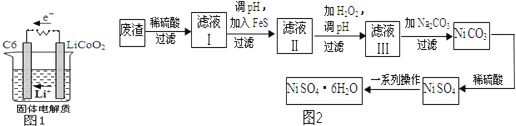
(4)![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣![]() 除含镍外,还含有Cu
除含镍外,还含有Cu![]() 为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去
为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
②向滤液Ⅱ中加入![]() ,溶液中发生反应的离子方程式为 ______ ,调节pH的目的是 ______ .
,溶液中发生反应的离子方程式为 ______ ,调节pH的目的是 ______ .
③滤液Ⅲ溶质的主要成分是![]() ,再加入碳酸钠过滤后,加稀硫酸溶解又生成
,再加入碳酸钠过滤后,加稀硫酸溶解又生成![]() 的目的是 ______ .
的目的是 ______ .
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作 ______ 极.
【答案】还原 2mol ![]() 充电 1 3 8 2 3 4
充电 1 3 8 2 3 4 ![]()
![]()
![]() 使
使![]() 水解生成氢氧化铁沉淀,以除去
水解生成氢氧化铁沉淀,以除去![]() 增大成
增大成![]() 浓度,有利于蒸发结晶 阳
浓度,有利于蒸发结晶 阳
【解析】
![]() 在稀硫酸和
在稀硫酸和![]() 的作用下可生成
的作用下可生成![]() ,Ce元素化合价降低,被氧化,结合化合价的变化计算;
,Ce元素化合价降低,被氧化,结合化合价的变化计算;
![]() 放电时,电池的正极发生还原反应,被
放电时,电池的正极发生还原反应,被![]() 还原生成
还原生成![]() ;根据电子和离子的定向移动方向判断电极;
;根据电子和离子的定向移动方向判断电极;
![]() 从质量守恒、电荷守恒和电子守恒的角度配平方程式;
从质量守恒、电荷守恒和电子守恒的角度配平方程式;
![]() 加入FeS,可转化为溶解度更小的难溶电解质;
加入FeS,可转化为溶解度更小的难溶电解质;
![]() 滤液Ⅱ中含有
滤液Ⅱ中含有![]() ,可与过氧化氢发生氧化还原反应生成
,可与过氧化氢发生氧化还原反应生成![]() ,调节pH,可有利于
,调节pH,可有利于![]() 的水解;
的水解;
![]() 从物质分离、提纯的角度思考;
从物质分离、提纯的角度思考;
![]() 电镀时,镀层金属作阳极,镀件金属为阴极。
电镀时,镀层金属作阳极,镀件金属为阴极。
![]() 在稀硫酸和
在稀硫酸和![]() 的作用下可生成
的作用下可生成![]() ,Ce元素化合价降低,被氧化,则
,Ce元素化合价降低,被氧化,则![]() 在该反应中作还原剂,每有
在该反应中作还原剂,每有![]() 参加反应,转移电子的物质的量为2mol;
参加反应,转移电子的物质的量为2mol;
![]() 放电时,电池的正极发生还原反应,被
放电时,电池的正极发生还原反应,被![]() 还原生成
还原生成![]() ,电极方程式为
,电极方程式为![]() ,图1中电子向
,图1中电子向![]() 极移动,如
极移动,如![]() 为负极,则移向
为负极,则移向![]() 的离子应为阴离子,而移向
的离子应为阴离子,而移向![]() 的为阳离子,则
的为阳离子,则![]() 应为阴极,此时该电池处于充电状态;
应为阴极,此时该电池处于充电状态;
![]() 反应中Cr元素化合价由
反应中Cr元素化合价由![]() 价降低到
价降低到![]() 价,S元素化合价由
价,S元素化合价由![]() 价升高到
价升高到![]() 价,则最小公倍数为12,配平后的离子方程式为
价,则最小公倍数为12,配平后的离子方程式为![]() ;
;
![]() 向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为![]() ;
;
![]() 双氧水
双氧水![]() 是强氧化剂,在酸性条件下氧化
是强氧化剂,在酸性条件下氧化![]() 生成
生成![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,调节溶液pH,则使
,调节溶液pH,则使![]() 水解生成氢氧化铁沉淀,以除去
水解生成氢氧化铁沉淀,以除去![]() ,选项答案为:使
,选项答案为:使![]() 水解生成氢氧化铁沉淀,以除去
水解生成氢氧化铁沉淀,以除去![]() ;
;
![]() 滤液Ⅲ溶质的主要成分是
滤液Ⅲ溶质的主要成分是![]() ,再加入碳酸钠过滤后,加稀硫酸溶解又生成
,再加入碳酸钠过滤后,加稀硫酸溶解又生成![]() ,可增大成
,可增大成![]() 浓度,有利于蒸发结晶,选项答案为:增大成
浓度,有利于蒸发结晶,选项答案为:增大成![]() 浓度,有利于蒸发结晶;
浓度,有利于蒸发结晶;
![]() 镀镍时,镍为镀层金属,应作阳极。
镀镍时,镍为镀层金属,应作阳极。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】在t℃下,某反应达到平衡,平衡常数K=c(NO)c(SO3)/c(NO2)c(SO2)。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
A.该反应的焓变为正值B.恒温下增大压强,反应体系的颜色加深
C.升高温度,逆反应速率减小D.该反应化学方程式为NO+SO3![]() NO2+SO2
NO2+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg 或lg
或lg ,下列叙述正确的是( )
,下列叙述正确的是( )

A.曲线m表示pH与lg 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-6.4
D.25℃时,CO32-+H2OHCO3-+OH-的水解常数为1.0×10-7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
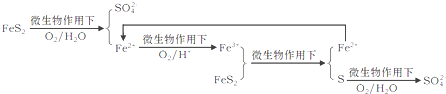
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的事实或应用、解释的说法不正确的是( )
事实或应用 | 解释 | |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 泡沫灭火器灭火 | Al2(SO4)3与NaHCO3溶液反应产生CO2气体 |
C | 施肥时,草木灰(主要成为K2CO3)与NH4Cl不能混合使用 | K2CO3与NH4Cl反应生成NH3,降低肥效 |
D | 明矾[KAl(SO4)2·12H2O]作净水剂 | 明矾溶于水生成Al(OH)3 胶体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是
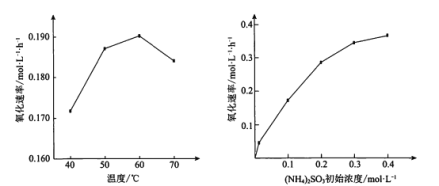
A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.基于硫代硫酸钠与稀硫酸反应生成S和![]() ,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测
,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测![]() 体积,计算出其反应速率
体积,计算出其反应速率
B.将两块未擦去氧化膜的铝片分别投入![]() 溶液、
溶液、![]() 溶液中,一段时间后,铝片表面都观察不到明显的反应现象
溶液中,一段时间后,铝片表面都观察不到明显的反应现象
C.将20g硝酸钠和17g氯化钾放入100mL烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体
D.试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用![]() 洗涤
洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是

A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
A.  B.
B.  C. C
C. C D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com