
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg 或lg
或lg ,下列叙述正确的是( )
,下列叙述正确的是( )

A.曲线m表示pH与lg 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-6.4
D.25℃时,CO32-+H2OHCO3-+OH-的水解常数为1.0×10-7.6
【答案】C
【解析】
溶液的pH越小,HCO3-和H2CO3的浓度越大,则m曲线代表lg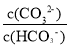
,n曲线代表lg 。
。
A、H2CO3的电离平衡常数Ka1>Ka2,Ka1=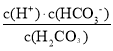 ,,Ka2=
,,Ka2=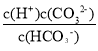 当pH相等时,
当pH相等时,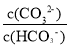 <
< ,lg
,lg >lg
>lg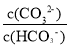 ,m曲线代表lg
,m曲线代表lg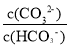 ,故A错误;
,故A错误;
B、当溶液为中性时,溶液中溶质为氯化钠、碳酸氢钠和碳酸,溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),则c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),故B错误;
C、Ka1(H2CO3)=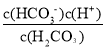 ,在N点lg
,在N点lg =1,即
=1,即 =10,N点的pH=7.4,则c(H+)=10-7.4mol/L,所以Ka1(H2CO3)=10×10-7.4=1.0×10-6.4,故C正确;
=10,N点的pH=7.4,则c(H+)=10-7.4mol/L,所以Ka1(H2CO3)=10×10-7.4=1.0×10-6.4,故C正确;
D、M点的pH=9.3,则c(H+)=10-9.3mol/L,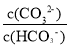 =-1,
=-1,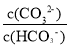 =10-1,Ka2(H2CO3)=
=10-1,Ka2(H2CO3)=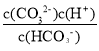 =10-1×10-9.3=1.0×10-10.3,25℃时,CO32-+H2OHCO3-+OH-的平衡常数为Kh=
=10-1×10-9.3=1.0×10-10.3,25℃时,CO32-+H2OHCO3-+OH-的平衡常数为Kh=![]() =
=![]() =1.0×10-3.7,故D错误。
=1.0×10-3.7,故D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中一定能大量共存的是
①pH=0的溶液:Na+、I-、NO3-、SO42-、
②pH=12的溶液中:![]() 、Na+、NO3-、S2-、
、Na+、NO3-、S2-、![]()
③水电离的H+浓度c(H+)=10-12 mol·L-1的溶液中:Cl-、![]() 、
、![]() 、
、![]() 、
、![]()
④加入Mg能放出H2的溶液中:Mg2+、![]() 、Cl-、K+、
、Cl-、K+、![]()
⑤使石蕊变红的溶液中:Fe2+、![]() 、Na+、
、Na+、![]()
⑥中性溶液中:Fe3+、Al3+、![]() 、Cl-、
、Cl-、
A.②④B.只有②C.①②⑤D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag请回答下列问题:
①该电池的负极材料是 ;电池工作时,阳离子向 (填“正极”或“负极”)移动;
②电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,反应的化学方程式为ZnO+C![]() Zn+CO↑,此法为 .
Zn+CO↑,此法为 .
A.电解法 B.热还原法 C.热分解法.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列有关叙述正确的是( )
①1mol苯中含有的碳碳双键数为3NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N﹣H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
A. ①④⑤⑦ B. ②⑤⑧ C. ②④⑤⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中,产生现象与对应的图形相符合的是( )
A.NaHSO3粉末加入HNO3溶液中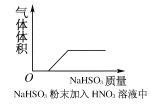
B.H2S气体通入氯水中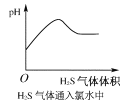
C.NaOH溶液滴入Ba(HCO3)2溶液中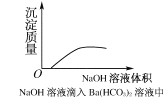
D.CO2气体通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是一种过渡元素,金属铁是最常用的金属材料。请回答下列有关问题:
(1)工业上常利用CO还原铁的氧化物冶炼铁。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19kJ/mol
请写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_____。
(2)11.2gFe与一定量的HNO3充分反应后,Fe全部溶解,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水槽中,气体恰好被完全吸收,O2的物质的量是____。
(3)利用电解实验可以制得纯净的Fe(OH)2,装置如图所示,两电极分别是石墨和铁,电解质溶液为NaCl溶液。
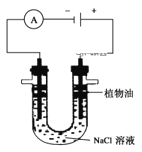
①植物油的作用是___,在加入植物油之前,要对NaCl溶液作何处理:____。
②阳极的电极反应式为____。
③若将该装置改为防止Fe发生电化学腐蚀的装置,则Fe电极应与电源____极相连,当电路中通过2mol电子时,两极共收集到气体___L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)写出R的原子结构示意图:________________
(2)五种元素原子半径由大到小的顺序是(写元素符号) .
(3)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,X和Z组成的化合物的化学式为___________________
(4)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
①如果A、B均由三种元素组成,B为两性不溶物,则A![]() B离子反应方程式为_________
B离子反应方程式为_________
②A、B均为盐溶液,如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用.
(1)二氧化铈![]() 是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用.
是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用.![]() 在稀硫酸和
在稀硫酸和![]() 的作用下可生成
的作用下可生成![]() ,
,![]() 在该反应中作 ______
在该反应中作 ______ ![]() 填“氧化”“还原”
填“氧化”“还原”![]() 剂,每有1mol
剂,每有1mol![]() 参加反应,转移电子的物质的量为 ______ .
参加反应,转移电子的物质的量为 ______ .
(2)某锂离子电池含![]() 导电固体为电解质.充电时,
导电固体为电解质.充电时,![]() 还原为Li,并以原子形式嵌入电极材料碳
还原为Li,并以原子形式嵌入电极材料碳![]() 中,以
中,以![]() 表示,电池反应为
表示,电池反应为![]() 则放电时,电池的正极反应式为 ______ ,图1表示该装置工作时电子和离子的移动方向,此时该电池处于 ______
则放电时,电池的正极反应式为 ______ ,图1表示该装置工作时电子和离子的移动方向,此时该电池处于 ______ ![]() 填“放电”或“充电”
填“放电”或“充电”![]() 状态.
状态.
(3)自然界Cr主要以三价Cr和六价Cr的形式存在.六价Cr能引起细胞的突变和癌变.可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式: ______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______ ,_____________
______ ,_____________
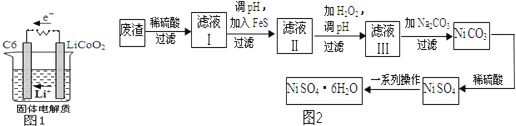
(4)![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣![]() 除含镍外,还含有Cu
除含镍外,还含有Cu![]() 为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去
为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
②向滤液Ⅱ中加入![]() ,溶液中发生反应的离子方程式为 ______ ,调节pH的目的是 ______ .
,溶液中发生反应的离子方程式为 ______ ,调节pH的目的是 ______ .
③滤液Ⅲ溶质的主要成分是![]() ,再加入碳酸钠过滤后,加稀硫酸溶解又生成
,再加入碳酸钠过滤后,加稀硫酸溶解又生成![]() 的目的是 ______ .
的目的是 ______ .
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作 ______ 极.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com