
【题目】下列有关电解质的叙述正确的是( )
A.液态HCl不导电,所以HCl是非电解质
B.熔融NaCl可以导电,所以NaCl是电解质
C.液态Cl2不导电,所以Cl2是非电解质
D.SO2的水溶液能够导电,所以SO2是电解质
科目:高中化学 来源: 题型:
【题目】以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学知识,按要求填空:

(1)上述第一级分类标准(分成A、B组)的依据为:___________。
(2)C组中某一物质常温能与冷水反应,其离子方程式为:_________________。
(3)D组中与水反应时氧化剂和还原剂物质的量之比为1:1的物质,有________(填化学式)。
(4)F组中某一物质的水溶液呈弱碱性,用电离方程式表示呈弱碱性的原因:________。
(5)E组中某一物质的水溶液可使酸性KMnO4溶液褪色,用离子方程式表示褪色的原因:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在48g碳不完全燃烧所得气体中,CO、CO2均占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1;CO(g)+
O2(g)═CO(g)△H=﹣110.5kJmol﹣1;CO(g)+![]() O2(g)═CO2(g)△H=﹣283kJmol﹣1.与这些碳完全燃烧相比,损失的热量是
O2(g)═CO2(g)△H=﹣283kJmol﹣1.与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJB. 1 149 kJC. 283 kJD. 566 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市场销售的食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生反应的化学方程式为:_______________________。
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 ____________________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________。
②b中反应所产生的I2的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是__________________ mg/kg。(以含w的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物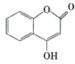 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:

(1)B→C的反应类型是__________。
(2)写出F和过量Na0H溶液共热时反应的化学方程式__________。
(3)下列关于G的说法正确的是__________(填字母)。
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3
(4)E的同分异构体很多,除E外符合下列条件的共__________种。
a.含苯环且能与氯化铁溶液显色, b.苯环上有两个取代基, c.含酯基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手性分子是指在分子结构![]() 中,当 a、b、x、y 为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
中,当 a、b、x、y 为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
A. 木糖醇 B. 丙氨酸
B. 丙氨酸
C. 葡萄糖 D. 甘油醛
D. 甘油醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下:

(1)A→B为加成反应,则B的结构简式是________;B→C的反应类型是________.
(2)G中含有的官能团名称是___________.
(3)D→E的化学方程式是__________________________反应类型为:__________.
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O—).H的结构简式是_____________.
(5)由C通过加聚反应合成的高分子化合物M的化学方程式为_______________________.
(6)下列说法正确的是______.
a.A能和HCl反应得到聚氯乙烯的单体 b.D和F中均含有酯基
c.1mol G完全燃烧生成8mol H2O d.F能发生加成反应、取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.B.C.D.E.F六种短期素的原子序数依次增大。已知A.C.F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次处层电子数比最外层电子数多3个。回答下列问题:
(1)写出B元素的符号________,画出E原子的外围电子的轨道表示式________。
(2)写出A.C两种元素最高价氧化物的水化物之间反应的离子方程式________________。最高价氧化物对应水化物的酸性:E________F(填“>”或“<”),写出F的最高价氧化物对应水化物的化学式________
(3)D的固态氧化物的晶体类型是________。
(4)30g的该氧化物的晶体中含D-O键的个数为________mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com