
(14分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。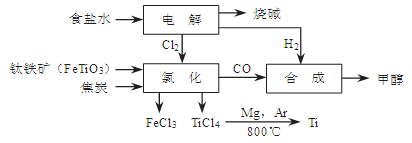
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)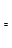 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是 。图中t3时改变的条件可能是 。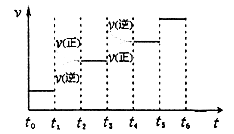
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图: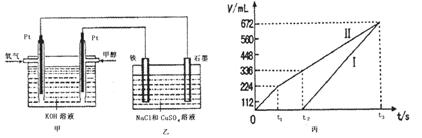
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L。(假设溶液体积不变)
⑴ 2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO(2分)
⑵① 向逆反应方向进行(2分)
②t2~t3 (2分)升高温度 (2分)
(3)①CH3OH-6e-+8OH-=CO32-+6H2O(2分)
②4OH--4e-=O2↑+2H2O (2分) 0.1(2分)
解析试题分析:⑴据流程图,钛铁矿氯化过程中反应物有FeTiO3、C、Cl2、,生成物有FeCl3、TiCl4、CO,然后根据氧化还原反应的配平方法将其配平。
⑵①此时该反应的浓度商Qc= >0.27(K),说明反应向逆反应方向进行;
>0.27(K),说明反应向逆反应方向进行;
②结合反应[CO(g)+2H2(g) CH3OH(g),正反应放热],并据图可确定“t1~t2”是加压,“t3~t4”是加热(升高温度),“t5~t6”是加催化剂;在t2~t3时间段内平衡混合物中的甲醇的含量最高。
CH3OH(g),正反应放热],并据图可确定“t1~t2”是加压,“t3~t4”是加热(升高温度),“t5~t6”是加催化剂;在t2~t3时间段内平衡混合物中的甲醇的含量最高。
⑶①装置甲为甲醇燃料电池,通入甲醇一极为负极,先根据得失电子守恒有CH3OH-6e-――CO32-,再根据电荷守恒有CH3OH-6e-+8OH―――CO32-,最后根据原子守恒得CH3OH-6e-+8OH-=CO32-+6H2O。
②装置乙为电解池,铁电极为阴极,该极发生的电极反应依次为Cu2++2e-=Cu,2H++2e-=H2↑;石墨为阳极,该极发生的电极反应式依次为2Cl--2e-=Cl2↑,4OH--4e-=O2↑+2H2O;据此可确定在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;根据在t1前发生的电极反应“2Cl--2e-=Cl2↑”可计算原混合溶液中NaCl的物质的量浓度: 。
。
考点: 本题考查氧化还原反应方程的书写、化学平衡的移动、化学平衡图像分析、电极反应式的书写与计算。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:单选题
在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价,氧化 1 mol FeCr2O4在理论上需要多少摩尔氧气
| A.2mol | B.2.5mol | C.3mol | D.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)某工业废水肿含有一定量的Cr2O72-和CrO42-,现
取样该工业废水,检测其中铬的含量。
步骤I:取25. 00 mL废水,加入适后稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,滴人几滴指示剂。
步骤Ⅲ: 用o .1000 mol·L-1Na2S2O3溶液滴定(I2+2Na2 S2O3= 2NaI+Na2S4O6)
达到终点时消耗溶液24. 00 mL。
步骤Ⅳ:将上述反应后的溶液进行如下处理:反应后废液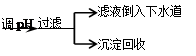
回答下列问题
(1)步骤I加入稀硫酸酸化的目的是 ;
(2)步骤Ⅱ中发生如下反应,请完善并配平离子方程式
该步骤中所加指示剂是 ;
(3)步骤Ⅲ判断滴定达到终点的现象是__ __。
(4)步骤Ⅳ在生产生活中的意义是____ (任答一条);
(5)计算工业废水中铬元素的含量是 mg/L.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。
其制备过程如下:
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na2SO3固体和某酸反应制备SO2气体;
③在一定温度下,将足量的SO2气体通入①的溶液中,即有保险粉生成,同时生成一种气体。
(1)写出NaOH的电子式
(2)制备SO2时所选用的酸,你认为下列最适宜选用的是
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ___________________________
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式_________________________________
(3)硫酸工业生产中在接触室中发生的反应的化学方程式_____________________________
(4)碳和浓硫酸反应的化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:____________
②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。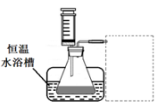
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。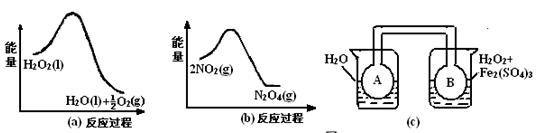
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。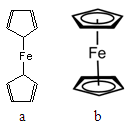
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式 。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是 。
(3)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为 ,其中1 mol KBrO3得到电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学生往一支试管里按一定次序分别加入下列几种物质:
| A.KI溶液, | B.淀粉溶液, | C.NaOH溶液, | D.氯水。发现溶液颜色按下面次序变化: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com