
分析 (1)能作为配合物配位体的微粒需含有孤对电子,CH4无孤对电子;
(2)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键;
(3)[Cu(NH3)4]SO4中阴阳离子间形成离子键,配离子[Cu(NH3)4]2+中含有配位键,不同非金属元素之间形成极性共价键,;
(4)形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如果为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(5)铜离子可以和一水合氨生成氢氧化铜沉淀,沉淀还可以溶于过量的氨水中;
(6)中和发生反应:H++OH-=H2O,由中和生成的H+需要的NaOH溶液,可得出H+物质的量,进而计算出x,[CrCln(H2O)6-n]x+中Cr的化合价为+3价,化合价代数和等于离子所带电荷,据此计算n的值,进而确定该配离子化学式.
解答 解:(1)A.H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,有孤对电子,可以作为配体,故A不选;
,有孤对电子,可以作为配体,故A不选;
B.NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为 ,有孤对电子,可以作为配体,故B不选;
,有孤对电子,可以作为配体,故B不选;
C.碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为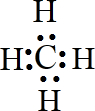 ,无孤对电子,不可以作为配体,故C选;
,无孤对电子,不可以作为配体,故C选;
D.Cl-为氯原子得到1个电子形成的阴离子,电子式为 ,有孤对电子,可以作为配体,故D不选;
,有孤对电子,可以作为配体,故D不选;
故答案为:C;
(2)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N,氨水中NH3分子与水分子间形成的可能存在的氢键N-H…O、O-H…N,
故答案为:N-H…O、O-H…N;
(3)[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与SO42-之间的化学键为离子键,[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,[Cu(NH3)4]SO4,
故答案为:①③⑤;
(4)形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如果为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为:a;
(5)氢氧化铜沉淀可以溶于过量的氨水中,发生反应:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;
(6)中和生成的H+需浓度为0.1200mol/L氢氧化钠溶液25.00mL,由H++OH-=H2O,可以得出H+的物质的量为0.12mol/L×25.00×10-3L=0.003mol,
所以x=$\frac{0.003mol}{0.0015mol}$=2,则[CrCln(H2O)6-n]2+中Cr的化合价为+3价,则有3-n=2,解得n=1,即该配离子的化学式为[CrCl(H2O)5]2+,
故答案为:[CrCl(H2O)5]2+.
点评 本题考查的内容较为综合,涉及到配位键、氢键、微粒的空间的结构及配合物化学式的求解等有关知识,注意基础知识的全面掌握,注意氢键、配合物的构成及性质,题目难度中等.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 天然气的主要成分是CH4 | |
| B. | 酸性:乙酸>碳酸>次氯酸 | |
| C. | 淀粉、纤维素、蚕丝、油脂都是高分子化合物 | |
| D. | 石油的分馏产品如汽油、煤油、柴油等都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O ( g )═H2 ( g )+$\frac{1}{2}$O2 ( g )△H=+242 kJ/mol | |
| B. | 2H2 ( g )+O2( g )═2H2O ( l )△H=-484 kJ/mol | |
| C. | H2 ( g )+$\frac{1}{2}$O2 ( g )═H2O (g )△H=+242 kJ/mol | |
| D. | 2H2 ( g )+O2 ( g )═2H2O ( g )△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 0.1000mol•L-1 HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 20.00 |
| 2 | 25.53 | 20.00 |
| 3 | 27.85 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物[Zn(NH3)4]Cl2配位数为6 | |
| B. | 配合物[Zn(NH3)4]Cl2中,配体为NH3和Cl-,[Zn(NH3)4]2+为内界 | |
| C. | 配合物[Zn(NH3)4]Cl2中Zn2+和NH3以离子键结合 | |
| D. | 在NH4+和Fe(CO)5中都存在配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C两种元素只能组成化学式为CA3的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F>C>D | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH不变仍为中性 | |
| B. | 向水中加入少量硫酸,c(H+)增大 | |
| C. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 一定温度下,向水中加入少量固体CH3COONa,平衡向正反应方向移动,Kw增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和石墨均为碳元素组成的单质 | |
| B. | CO2:弱电解质 | |
| C. | 蓝矾(CuSO4•5H2O)和干冰属于化合物,铁矿石属于混合物 | |
| D. | 醋酸:一元弱酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com