
| A、Fe2+ |
| B、Fe3+和Fe2+ |
| C、Fe3+ |
| D、Fe3+、Cl- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 |
| B、pH=3的盐酸和pH=11的氨水等体积混合 |
| C、pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
| D、pH=3的硫酸和pH=11的氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
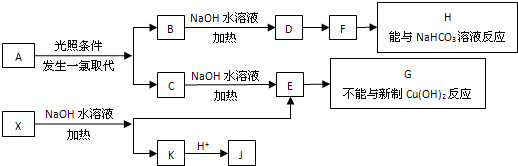
查看答案和解析>>
科目:高中化学 来源: 题型:
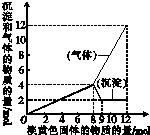 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成;加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,问所加淡黄色固体是
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成;加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,问所加淡黄色固体是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-甲基丙烷的一氯取代物有两种 |
B、 和 和 互为同系物 互为同系物 |
| C、顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 |
D、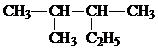 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-═Al(OH)3↓ |
| B、90℃时,测得纯水中c(H+)?c(OH-)═3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 |
| C、FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| D、碳酸钠溶液滴入酚酞变红:CO32-+2H2O?H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在氯气中剧烈燃烧,生成黑烟 | ||||
| B、钠熔化成小球,与氯气缓慢反应,有蓝色火焰 | ||||
C、该反应的化学方程式为:Na+Cl
| ||||
| D、反应后,钠原子失去电子变成钠离子,氯原子得到电子变成氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:9 | B、9:1 |
| C、10:1 | D、1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
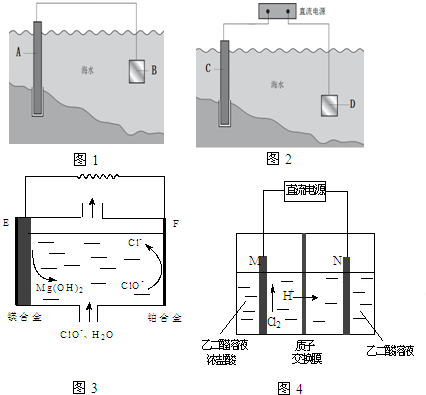 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com