
分析 烧瓶质量增重的4.32g为析出Ag的质量,其物质的量为0.04mol,醛的质量=10g×11.6%=1.16g,若为甲醛,则甲醛为0.01mol,其质量为0.01mol×30g/mol=0.3g<1.16g,不能是甲醛,该醛的组成为R-CHO,由R-CHO~2Ag计算醛的物质的量,进而确定其分子式.
解答 解:烧瓶质量增重的4.32g为析出Ag的质量,其物质的量为$\frac{4.32g}{108g/mol}$=0.04mol,醛的质量=10g×11.6%=1.16g,若为甲醛,由HCHO~4Ag,则甲醛为0.01mol,其质量为0.01mol×30g/mol=0.3g<1.16g,不能是甲醛,
该醛的分子式为CnH2nO,
R-CHO~2Ag
1mol 2mol
0.02mol 0.04mol
故醛的相对分子质量为$\frac{1.16}{0.02}$=58,去掉1个-CHO后剩余原子总相对原子质量为58-29=29,剩余基团中最大碳原子数目为$\frac{29}{12}$=2…5,该醛的分子式为C3H6O,结构简式为CH3CH2CHO,名称是丙醛,
答:醛结构简式为CH3CH2CHO,名称是丙醛.
点评 本题考查有机物分子式确定、化学计算,关键是根据醛基与Ag的物质的量关系计算醛的相对分子质量,难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③ | C. | ③④⑥ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
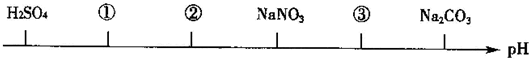
| A. | CuCl2 CH3COOH NaOH | B. | HCl H2SO3 NaHCO3 | ||
| C. | HF HCl CH3COONa | D. | NH4Cl HCl CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)═2CO(g) 的△H=+172.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C10H8和C6H8O3 | B. | C2H2和C6H6 | C. | C2H4和C3H6 | D. | CH4和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y2?XY2 | D. | 2X2+Y2?2X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeSO4溶液中通入过量Cl2 | |
| B. | 向NaHCO3溶液中加入一定质量的Na2O2粉末 | |
| C. | 向NaI和NaBr混合溶液中通入过量Cl2 | |
| D. | 向NaOH溶液中加入过量AlCl3(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com