
| A. | 向FeSO4溶液中通入过量Cl2 | |
| B. | 向NaHCO3溶液中加入一定质量的Na2O2粉末 | |
| C. | 向NaI和NaBr混合溶液中通入过量Cl2 | |
| D. | 向NaOH溶液中加入过量AlCl3(SO4)3 |
分析 A.根据硫酸难挥发,盐酸易挥发,FeSO4溶液和过量Cl2反应生成Fe2(SO4)3和FeCl3,Fe2(SO4)3再加热蒸干得到硫酸铁;FeCl3再加热蒸干,得到后氢氧化铁来解答;
B.1mol过氧化钠与水反应生成2mol氢氧化钠,氢氧化钠与碳酸氢钠按1:1恰好反应生成碳酸钠;
C.根据NaI、NaBr在高温下不会分解,氯气会把碘和溴氧化出来,最终碘和溴和水挥发,只剩KCl、NaCl来解答;
D.NaOH溶液中加入过量AlCl3可以生成氢氧化铝沉淀,灼烧会分解.
解答 解:A.FeSO4溶液和过量Cl2反应生成Fe2(SO4)3和FeCl3,Fe2(SO4)3加热水解生成氢氧化铁和硫酸,硫酸难挥发,再加热蒸干并在300℃时充分灼烧至质量不变得到硫酸铁;FeCl3加热水解生成氢氧化铁和氯化氢,灼烧后氢氧化铁分解产生氧化铁和水,所以得到的是Fe2(SO4)3和Fe2O3混合物,故A错误;
B.1mol过氧化钠与水反应生成2mol氢氧化钠,2mol氢氧化钠与2mol碳酸氢钠按恰好反应生成碳酸钠,加热蒸干、灼烧,残留固体为碳酸钠,但是如果借入的过氧化钠偏多是,会出现氢氧化钠产物,不合题意,故B错误;
C.因NaI、NaBr在高温下不会分解,氯气会把碘和溴氧化出来,加热蒸干、灼烧至质量不变,碘升华,溴和水挥发,加热蒸干、灼烧,残留固体为NaCl,故C正确;
D.向NaOH溶液中加入过量AlCl3会生成氯化钠和氢氧化铝,还有剩余的氯化铝存在,加热蒸干并在300℃时充分灼烧至质量不变,最终能得到氯化钠和氧化铝,故D错误.
故选C.
点评 本题考查了物质性质的应用,物质反应量不同产物不同,水解的盐蒸干溶液得到水解产物还是原溶质取决于水解生成物的挥发性,盐的性质,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
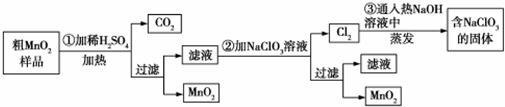
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
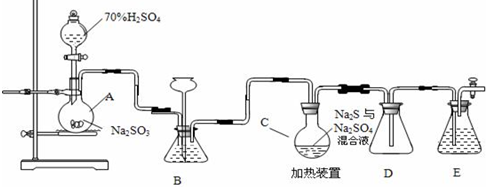
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 任何气体所含的分子数均为NA | |
| B. | 14 g氮气所含的氮原子数为NA | |
| C. | 标准状况下,22.4 L水所含的水分子数为NA | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
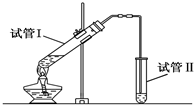 实验室用如图所示装置制备少量乙酸乙酯.
实验室用如图所示装置制备少量乙酸乙酯. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com