
【题目】锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环境无污染。已知电池的总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A. 电池在放电时,Li+向电源负极移动
B. 充电时阳极的反应为LixV2O5-xe-===V2O5+xLi+
C. 放电时负极失重7.0 g,则转移2 mol电子
D. 该电池以Li、V2O5为电极,酸性溶液作介质
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】银锌纽扣电池如图,电池反应式为:![]() ,下列说法正确的是( )
,下列说法正确的是( )
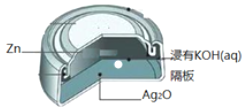
A.锌作负极
B.电池工作时,电流从Zn经导线流向Ag2O
C.正极发生还原反应
D.负极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A. a点KW=1.0×10-14
B. b点:c(NH)>c(Cl-)>c(H+)>c(OH-)
C. 25 ℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D. d点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得 Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3(NH4) 2SO424H2O]流程设计如下:

已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;Ⅱ.CeO2不溶于稀硫酸,也不溶于 NaOH溶液。
回答以下问题:
(1)反应②中H2O2的作用是___________。
(2)反应③的离子方程式是________。
(3)已知有机物 HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是_______。
2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是_______。
(4)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是___________。
(5)用滴定法测定制得的 Ce(OH)4 产品纯度。
![]()
若所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4 产品的质量分数____。(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
(1)在基态14C原子中,核外存在___对自旋相反的电子,基态氮原子的价层电子排布图为____。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为__其中氧原子的杂化方式为_______。
(3)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中充入1 mol CO2(g)和3.5 mol H2(g),在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。反应进行8 min时达到平衡状态,测得n(CH3OH)=0.5mol。该反应的平衡常数K与温度T的关系如图1所示,CO2的转化率如图2所示,下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0。反应进行8 min时达到平衡状态,测得n(CH3OH)=0.5mol。该反应的平衡常数K与温度T的关系如图1所示,CO2的转化率如图2所示,下列说法错误的是

A. 在图1中,曲线Ⅱ表示该反应的平衡常数K与温度T的关系
B. 该温度下,平衡常数K=0.25
C. 其他条件不变下,图2中x可表示温度或压强或投料比c(CO2)/c(H2)
D. 用二氧化碳合成甲醇体现了碳减排理念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___。
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝—空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
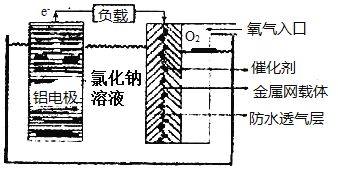
该电池的正极反应方程式为___,当铝电极质量减少9克,则另一极通入的氧气的体积在标准状况下为___。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。写出反应化学方程式为___。
(4)在元素周期表中,砷位于铝的下一周期,与氮元素同主族,写出AsH3分子的电子式为___,相同压强下,AsH3的沸点___NH3(填“大于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g)![]() CO(g)+2H2(g) △H1=+90.64 kJ·mol-1;
CO(g)+2H2(g) △H1=+90.64 kJ·mol-1;
水蒸气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.20 kJ·mol-1。
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1。
则CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H3=___________kJ·mol-1。
CO2(g)+3H2(g) △H3=___________kJ·mol-1。
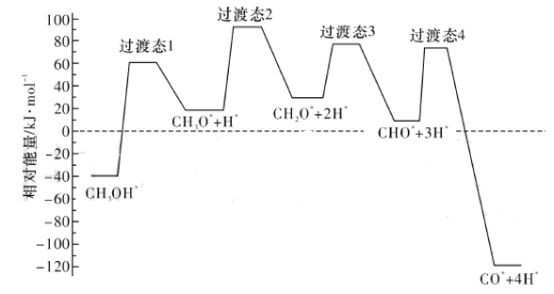
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(III)表面发生解离时四个路径与相对能量的关系如图所示,其中附在Pd(III)表面的物种用*标注。此历程中活化能最小的反应方程式为_____________________________________________。
(3)在0.1MPa下,将总进料量为1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水蒸气变换反应的速率随温度的升高明显下降,原因是____________________。
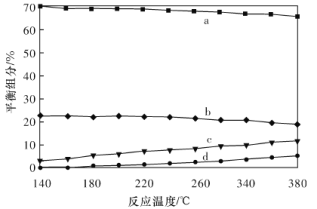
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分的含量与反应温度的关系如图所示,曲线b、c对应物质的化学式分别为________、________。
(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____MPa·h-1,其分压平衡常数Kp=_____MPa2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以物质a为原料,制备物质(金刚烷)的合成路线如下图所示
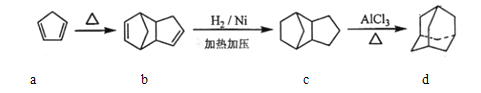
关于以上有机物说法中错误的是
A. 物质b的分子式为C10H12B. b可以由2mola反应得到,发生的是加成反应
C. 物质c与物质d互为同分异构体D. 物质d的二氯代物有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com