
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g) △H<0。
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为______mol。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是______________。
(3)还可利用ClO2 消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):
NO ![]() NO2
NO2  N2
N2
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO2物质的量相等,则化学反应方程式为_____,反应中若生成22.4L N2(标准状况),则消耗ClO2_____g。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
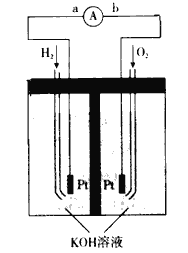
①氢氧燃料电池的能量转化主要形式是_______,工作时电流方向为____(用a、b和箭头表示)。
②负极的电极反应式为________________。
③电极表面镀铂粉的原因为____________。
【答案】> 6 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ·mol﹣1 2NO + ClO2 + H2O = NO2 + HNO3 + HCl 135 化学能→电能 b→a H2﹣2e﹣+2OH﹣=2H2O 增大电极单位面积吸附H2和O2的分子数,增大反应速率
【解析】
(1)①该反应为放热反应;
②由元素化合价的变化可知,该反应中还原剂为NH3,氧化剂为NO和NO2;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、氯化氢以及二氧化氮,反应方程式为:2NO+ClO2+H2O=NO2+HNO3+HCl,反应生成的NO2与Na2SO3发生氧化还原反应生成氮气和硫酸钠,反应的化学方程式为2NO2+4Na2SO3=N2+4Na2SO4;
(4)该装置是把化学物质中的能量转化为电能,碱性环境中,负极上氢气失电子生成氢离子,电极反应式为H2+2OH--2e-=2H2O,正极上氧气得电子生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,电子的流向是从负极经导线流向正极。
(1)①该反应为放热反应,反应物总能量大于生成物总能量,故答案为:>;
②由化学方程式可知,当该反应有2molN2(g)生成时,反应消耗还原剂NH3的物质的量为2mol,则反应的电子转移的量是2 mol×3=6mol,故答案为:6;
(2)将已知反应依次编号为①②,根据盖斯定律②×2-①可得CH4(g)将NO(g)还原为N2(g)的方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),则△H=[2×(-867kJ/mol)-(-574kJ/mol)]=-1160kJmol-1,故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJmol-1;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、氯化氢以及二氧化氮,由硝酸与NO2物质的量相等可知反应方程式为:2NO+ClO2+H2O=NO2+HNO3+HCl;反应生成的NO2与Na2SO3发生氧化还原反应生成氮气和硫酸钠,反应的化学方程式为2NO2+4Na2SO3=N2+4Na2SO4,由反应的两个化学方程式可知,ClO2和N2的关系式为:2ClO2~2NO2~N2,标准状况下,反应中生成22.4L N2的物质的量为1mol,则n(ClO2)=2n(N2)=2 mol,m(ClO2)=2mol×67.5g/mol=135g,故答案为:2NO+ClO2+H2O=NO2+HNO3+HCl;135;
(4)①该装置是把化学物质中的能量转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极经导线流向正极,所以是由a到b,电流方向为b→a,故答案为:化学能转变为电能;b→a;
②碱性环境中,负极上氢气失电子生成氢离子,电极反应式为H2+2OH--2e-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
③电极表面镀铂粉,增大了电极单位面积吸附H2、O2的分子数,使反应物的浓度增大,反应速率加快,故答案为:增大电极单位面积吸附H2和O2的分子数,加快电极反应速率。


科目:高中化学 来源: 题型:
【题目】下列酸与碱中和反应热化学方程式可用:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1来表示的是(Q1,Q2,Q3,Q4都大于0) ( )
A. CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
B. ![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
C. HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1
D. ![]() H3PO4(aq)+
H3PO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)= ![]() Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途对应关系正确的是
性质 | 用途 | |
A | 硅酸钠化学性质稳定 | 制备木材防火剂 |
B | 硅酸溶胶具有 吸附水分的能力 | 硅作半导体的材料 |
C | 二氧化硅硬度大、熔点高 | 氢氟酸在玻璃上刻花纹 |
D | 焦炭具有可燃性 | 焦炭还原二氧化硅 冶炼粗硅 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是
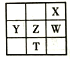
A. X、W、Z的原子半径依次递减
B. Y、Z、W的最高价氧化物的水化物酸性依次递减
C. 根据元索周期表推测T元素的单质具有半导体特性
D. 最低价阴离子的失电子能力X比W强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
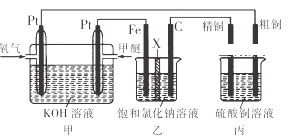
A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe﹣2e ﹣=Fe2+
C. 通入氧气的一极为正极,发生的电极反应为O2﹣4e ﹣+2H2O═4OH﹣
D. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是( )
A.地壳中金属元素的含量
B.金属的延展性
C.金属的导电性
D.金属活动性及冶炼的难易程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A~D四种物质均含有同一种元素,A可以是单质也可以是气态氢化物,D是该元素最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是
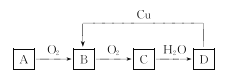
A. 氯 B. 铁 C. 碳 D. 氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80g CuSO45H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。
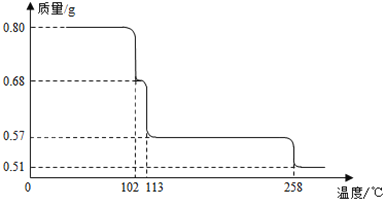
请回答下列问题:
(1)试确定 200℃时固体物质的化学式_________;
(2)取 270℃所得样品,于 570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_______________________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为__________,其存在的最高温度是__________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带除供食用外,大量用于制碘。提取碘的途径如下所示,正确的是
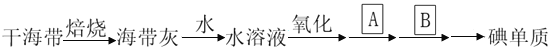
A. 碘元素在海水中也有游离态存在
B. 在提取的过程中用的氧化剂可以是H2O2
C. 操作A是结晶或重结晶
D. B是提纯操作,常用蒸馏或分馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com