
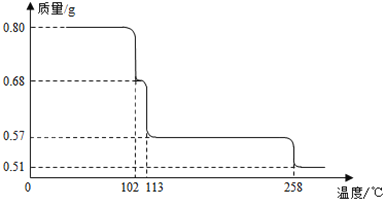
【题目】80g CuSO45H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。
请回答下列问题:
(1)试确定 200℃时固体物质的化学式_________;
(2)取 270℃所得样品,于 570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_______________________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为__________,其存在的最高温度是__________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为_______________________。
【答案】CuSO4·H2OCuSO4 ![]() CuO+SO3↑CuSO4·5H2O 102℃2H2SO4(浓)+ Cu
CuO+SO3↑CuSO4·5H2O 102℃2H2SO4(浓)+ Cu![]() CuSO4 +SO2↑+H2O
CuSO4 +SO2↑+H2O
【解析】
(1)CuSO45H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO45H2O![]() CuSO4(5-n)H2O+nH2O
CuSO4(5-n)H2O+nH2O
250 18n
0.80g 0.80g-0.57g=0.23g
![]() =
=![]() ,解得n=4,即200℃时该固体物质的化学式为CuSO4H2O,故答案为CuSO4H2O;
,解得n=4,即200℃时该固体物质的化学式为CuSO4H2O,故答案为CuSO4H2O;
(2)温度为570℃灼烧得到的黑色粉末应是CuO,氧化性气体则为SO3,反应方程式为:CuSO4 ![]() CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO45H2O;其存在的最高102℃,故答案为:CuSO4
CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO45H2O;其存在的最高102℃,故答案为:CuSO4![]() CuO+SO3↑; CuSO45H2O;102℃;
CuO+SO3↑; CuSO45H2O;102℃;
(3)SO3与水反应生成硫酸,浓硫酸与铜加热反应的化学方程式为:2H2SO4(浓)+Cu![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】在100mL溴化亚铁溶液中通入2.24L氯气(标准状况),若有三分之一的溴离子被氧化,则原溴化亚铁溶液的物质的量浓度为( )
A. 3mol/L B. 1. 2mol/L
C. 1. 5mol/L D. 2.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g) △H<0。
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为______mol。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是______________。
(3)还可利用ClO2 消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):
NO ![]() NO2
NO2  N2
N2
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO2物质的量相等,则化学反应方程式为_____,反应中若生成22.4L N2(标准状况),则消耗ClO2_____g。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
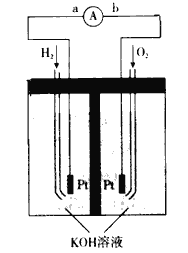
①氢氧燃料电池的能量转化主要形式是_______,工作时电流方向为____(用a、b和箭头表示)。
②负极的电极反应式为________________。
③电极表面镀铂粉的原因为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子层数相同的三种元素X、Y、Z,已知最高价氧化物对应水化物的酸性HXO4>H2YO4>H3ZO4,则下列判断错误的是 ( )
A. 原子半径X<Y<Z
B. 气态氢化物的稳定性HX>H2Y>ZH3
C. 非金属性Z>Y>X
D. 阴离子的还原性X-<Y2-<Z3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
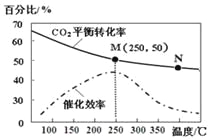
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 常温下,7.8g固体Na2O2中,含有的阴离子数为0.2NA
B. 4℃时,18g 2H216O中含有共用电子对数为2NA
C. 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,正极产生2.24LH2
D. 1 mol N5+含有的电子数为34NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)H1=-53.7kJ/mol
CH3OH(g)+H2O(g)H1=-53.7kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+ H2O(g)H2
CO(g)+ H2O(g)H2
某实验控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知: ①CO和H2的标准燃烧热分别为-283.0kJ/mol和285.8kJ/mol
②H2O(1)![]() H2O(g) H3=+440kJ/mol
H2O(g) H3=+440kJ/mol
请回答(不考虑温度对H的影响):
(1)a.反应II的H2=____kJ/mol。
b.800℃时,反应I和II对应的平衡常数分别为1.0和2.5,则该温度下反应:CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K的数值为_____。
CH3OH(g)的平衡常数K的数值为_____。
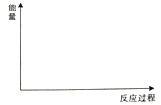
(2)在图中分别画出I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的催化剂) ____。
(3)工业生产甲醇还有如下方法:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
副反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
若生产过理中在恒压条件下通入水蒸气,从化学平衡的角度分析该操作对生产甲醇带来的利和弊____。
(4)利用光能和光催化剂,可將CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(1、I、III)作用下,CH4产量随光照时间的变化如下图所示。下列说法正确的是____
A.催化剂能加快化学反应速率,在反应开始时对正反应的催化效果更好
B.从图中可知催化剂I的催化效果更好
C.若光照时间足够长,三条由线将相交于一点
D.光照15h前,无论用所给的哪种催化剂,该反应均未达到平衡
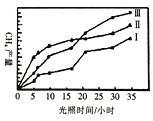
(5)人们正在研究某种锂一空气电池,它是一种环境友好的蓄电池。放电时的总反应为:4Li+O2=2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可是按两步反应进行,请补充完整。
电极反应式:______和Li2O2-2e-=2Li++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA
B. 1.5 mol CH4所含的电子数为15 NA
C. 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
D. 常温常压下,11.2 L Cl2含氯原子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com