
【题目】在100mL溴化亚铁溶液中通入2.24L氯气(标准状况),若有三分之一的溴离子被氧化,则原溴化亚铁溶液的物质的量浓度为( )
A. 3mol/L B. 1. 2mol/L
C. 1. 5mol/L D. 2.0mol/L
【答案】B
【解析】还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,根据n=![]() 计算氯气的物质的量,令原溶液中FeBr2的物质的量为amol,利用电子转移守恒计算a的值,再根据c=
计算氯气的物质的量,令原溶液中FeBr2的物质的量为amol,利用电子转移守恒计算a的值,再根据c=![]() 计算原FeBr2溶液的物质的量浓度。
计算原FeBr2溶液的物质的量浓度。
详解:标准状况下2.24L氯气的物质的量为![]() =0.1mol,还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,令原溶液中FeBr2的物质的量为amol,根据电子转移守恒,则:amol×(3-2)+
=0.1mol,还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,令原溶液中FeBr2的物质的量为amol,根据电子转移守恒,则:amol×(3-2)+![]() [0-(-1)]=0.1mol×2,计算得出a=0.12,
[0-(-1)]=0.1mol×2,计算得出a=0.12,
故原FeBr2溶液的物质的量浓度![]() =1.2mol/L,
=1.2mol/L,
所以B选项是正确的。


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】钠硝石又名智利硝石,主要成分为NaNO3。据最新勘探预测表明,我国吐鲁番盆地钠硝石资源量约2.2亿吨,超过了原世界排名第一的智利。一种以钠硝石为原料制备KNO3的流程如下图所示(矿石中其他物质均忽略):

相关化合物溶解度随温度变化曲线如下图所示:

回答下列问题:
(1) NaNO3是________________(填“电解质”或“非电解质”)。
(2) 一定温度下,NaNO3可分解生成Na2O、NO和O2,该反应的化学方程式为__________________。
(3) 为提高钠硝石的溶浸速率,可对矿石进行何种预处理________________(答出一种即可)。
(4) 为减少KNO3的损失,步骤a的操作应为:________________________________;
步骤b中控制温度可为下列选项中的________。
A.10℃ B.40℃ C.60℃ D.90℃
(5) 如何验证洗涤后的KNO3中没有Cl-:_______________________________________。
(6) 若100吨钠硝石可生产60.6吨KNO3,则KNO3的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸与碱中和反应热化学方程式可用:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1来表示的是(Q1,Q2,Q3,Q4都大于0) ( )
A. CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
B. ![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
C. HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1
D. ![]() H3PO4(aq)+
H3PO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)= ![]() Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
Ba3(PO4)2(s)+H2O(l) ΔH=-Q4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H+、Na+、Al3+、Ba2+、OH、HCO3、Cl七种离子中的两种可以形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H2O未标出),下列说法不正确的是
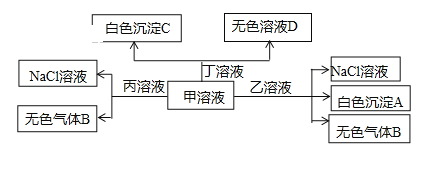
A. 白色沉淀A可能能溶解在溶液D中
B. 在甲中滴加丁可能发生反应:HCO3 + Ba2+ + OH == BaCO3 ↓ + H2O
C. 溶液丙与I、NO3、SO42 可以大量共存
D. 溶液乙一定是AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是()
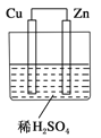
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-==Cu2+,发生氧化反应
A. ①②③B. ②④C. ②③④D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
⑴ 浓盐酸与铁屑反应:2Fe + 6H+ == 2Fe3+ + 3H2↑
⑵ 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42- == 2BaSO4↓+Al(OH)3↓
⑶ 过量二氧化碳通入偏铝酸钠溶液中:AlO2- + CO2 + 2H2O == Al(OH)3↓ + HCO3-
⑷ 碳酸氢铵溶液与过量氢氧化钠溶液混合共热: NH4+ + HCO3- + 2OH- ![]() CO32- + NH3↑ + 2H2O
CO32- + NH3↑ + 2H2O
⑸ NaHCO3溶液与稀H2SO4反应:CO32- + 2H+ == H2O + CO2↑
⑹ MnO2 与浓盐酸反应制Cl2:MnO2 + 4HCl == Mn2++ 2Cl-+ Cl2↑+ 2H2O
⑺ 明矾溶于水产生Al(OH)3 胶体:Al3++3H2O == Al(OH)3↓+ 3H+
⑻ Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- + Ca2+ + OH-== CaCO3↓+ H2O
⑼ 苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5Oˉ → 2C6H5OH + CO32ˉ
⑽ Fe(NO3)3 溶液中加入过量 HI 溶液: 2Fe3+ + 2I-== 2Fe2+ + I2
A. ⑵⑶⑷⑹ B. ⑶⑷⑸⑻⑽ C. ⑶⑷⑻ D. ⑴⑶⑷⑺⑻⑼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途对应关系正确的是
性质 | 用途 | |
A | 硅酸钠化学性质稳定 | 制备木材防火剂 |
B | 硅酸溶胶具有 吸附水分的能力 | 硅作半导体的材料 |
C | 二氧化硅硬度大、熔点高 | 氢氟酸在玻璃上刻花纹 |
D | 焦炭具有可燃性 | 焦炭还原二氧化硅 冶炼粗硅 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是
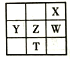
A. X、W、Z的原子半径依次递减
B. Y、Z、W的最高价氧化物的水化物酸性依次递减
C. 根据元索周期表推测T元素的单质具有半导体特性
D. 最低价阴离子的失电子能力X比W强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80g CuSO45H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。
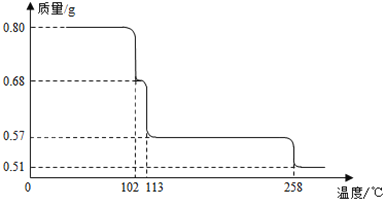
请回答下列问题:
(1)试确定 200℃时固体物质的化学式_________;
(2)取 270℃所得样品,于 570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_______________________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为__________,其存在的最高温度是__________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com