
【题目】下图是酸雨形成过程,则相关说法错误的是( )
A.pH<6.5的雨水称作酸雨
B.在酸雨形成过程中发生了氧化还原反应
C.二氧化硫和氮氧化物被列为空气质量日报表首要污染物
D.防止酸雨,应调整能源结构,优化能源质量,从源头上控制SO2、NOx的排放
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+ ,
(1)请写出其第l步反应的离子方程式。
(2)总化学反应方程式
(3)利用Cu制备CuSO4的另一种方法可用化学方程式表示为。
(4)以上两种方法(填“前”、“后”) 者好,这样做的好处是① ,②。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述中正确的是( )
A.Na2O中的Na+和O2-的核外电子排布不相同
B.106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.Cl-的结构示意图为 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.含有0.1 molL-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.含有0.1 molL-1 Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
① 表中属于d区的元素是(填编号)。
②表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为。
③某元素的特征电子排布式为nsnnpn+1 , 该元素原子的最外层电子的孤电子对数为。
④某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置除去含CN﹣、Cl﹣废水中的CN﹣时,控制溶液pH为9~10,某电极上产生的ClO﹣将CN﹣氧化为两种无污染的气体,下列说法正确的是( ) 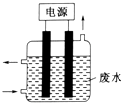
A.可以用石墨作阳极,作铁阴极
B.除去CN﹣的反应:2CN﹣+5ClO﹣+2H+═N2↑+2CO2↑+5Cl﹣+H2O
C.阴极的电极反应式为:Cl﹣+2OH﹣+2e﹣═ClO﹣+H2O
D.阳极的电极反应式为:2CN﹣+12OH﹣﹣10e﹣═N2↑+2CO32﹣+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com