
����Ŀ�����գ�ij�����Ŷӳɹ��ϳ���Ni��Fe˫ԭ�Ӵ���(Ni/Fe��C��N)����Ӧ���ڸ�Ч��CO2��ԭ���ش��������⣺
(1)��̬��ԭ�ӵļ۵��ӹ���Ų�ͼΪ__����Ԫ�س�����������Fe2+��Fe3+���ȶ���Fe2+__Fe3+(����>������<��)��ԭ����__��
(2)C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ__��
(3)���ɽ��������Ni(CO)n������ԭ�Ӽ۵�������CO�ṩ��λ�ĵ�������֮��Ϊ18����n=___���û����������ڱ������Ȼ�̼���л��ܼ���ԭ����___��
(4)��ï���ĽṹΪ![]() ����Fe2+��
����Fe2+��![]() (�����ϩ��������)���ɡ�һ��
(�����ϩ��������)���ɡ�һ��![]() ����������Ϊ__��Cԭ�ӵ��ӻ��������Ϊ__��
����������Ϊ__��Cԭ�ӵ��ӻ��������Ϊ__��
(5)ijC��Fe�Ͻ�ľ����ṹ��ͼ��ʾ��
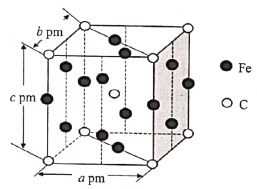
�úϽ�Ļ�ѧʽΪ__�����þ���ľ�������Ϊapm��bpm��cpm����=��=��=90o���ܶ�Ϊ��g��cm-3����NAΪ__(д������ʽ����)��
���𰸡�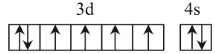 < Fe3+��3d���Ϊ����״̬�����ȶ� N>O>C 4 Ni(CO)4���ڷǼ��Է��ӣ������ڷǼ����ܼ��� 10 sp2 Fe3C
< Fe3+��3d���Ϊ����״̬�����ȶ� N>O>C 4 Ni(CO)4���ڷǼ��Է��ӣ������ڷǼ����ܼ��� 10 sp2 Fe3C ![]() mol-1
mol-1
��������
����ԭ�Ӽ����ӵĵ����Ų�ʽ����������ͬ��������Ԫ�ص�һ�����ܵĵݱ�����жϣ����ݼ۲���Ӷ���Ŀ�ͼ۲����Ѱ�������۷���ԭ�ӵ��ӻ����ͺͿռ乹�ͣ����ݾ����ṹ��������Ļ�ѧʽ��������ؼ��㡣
(1)��̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2����۵��ӹ���Ų�ͼΪ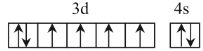 ��Fe2+�ĵ����Ų�ʽΪ1s22s22p63s23p63d6��Fe3+�ĵ����Ų�ʽΪ1s22s22p63s23p63d5���ɼ�Fe3+��3d���Ϊ����״̬�����ȶ������ȶ���Fe2+��Fe3+��
��Fe2+�ĵ����Ų�ʽΪ1s22s22p63s23p63d6��Fe3+�ĵ����Ų�ʽΪ1s22s22p63s23p63d5���ɼ�Fe3+��3d���Ϊ����״̬�����ȶ������ȶ���Fe2+��Fe3+��
(2)C��N��O��ͬ��������Ԫ�أ��˵������һ�����ܳ��������ƣ���Nԭ�ӵ�2p3����ǰ�����ṹ����ͬ�ȶ���������Ԫ�صĵ�һ�������ɴ�С��˳��ΪN>O>C��
(3)Ni�ļ۵�����Ϊ10��ÿ�������ṩһ�����Ӷԣ���10+2n=18��n=4���������Ȼ�̼��Ϊ�Ǽ����ܼ���������������ԭ�����û����������ڱ������Ȼ�̼���л��ܼ���˵��Ni(CO)4���ڷǼ��Է��ӣ������ڷǼ����ܼ��У�
(4)������Ϊ��������һ��![]() (�����ϩ��������)����������Ϊ10��
(�����ϩ��������)����������Ϊ10��![]() �ṹ��̼ԭ�ӵļ۲���Ӷ�����Ϊ3����Cԭ�ӵ��ӻ��������Ϊsp2�ӻ���
�ṹ��̼ԭ�ӵļ۲���Ӷ�����Ϊ3����Cԭ�ӵ��ӻ��������Ϊsp2�ӻ���
(5)�úϽ���Feԭ����Ϊ4��![]() +10��
+10��![]() =6��Cԭ����Ϊ8��
=6��Cԭ����Ϊ8��![]() +1=2����Ͻ�Ļ�ѧʽΪFe3C������������Ϊ
+1=2����Ͻ�Ļ�ѧʽΪFe3C������������Ϊ![]() g�����������Ϊabc��10-30cm3������
g�����������Ϊabc��10-30cm3������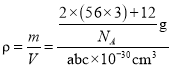 ��֪��NA=
��֪��NA=![]() mol-1��
mol-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 L�ܱ������г���6 mol A�����5 mol B���壬��һ�������·�����Ӧ��3A(g)��B(g)![]() 2C(g)��xD(g)��5 s�ﵽƽ�⡣�ﵽƽ��ʱ��������2 mol C�����ⶨD��Ũ��Ϊ0.5 mol��L��1�������ж���ȷ����( )
2C(g)��xD(g)��5 s�ﵽƽ�⡣�ﵽƽ��ʱ��������2 mol C�����ⶨD��Ũ��Ϊ0.5 mol��L��1�������ж���ȷ����( )
A. x��1B. B��ת����Ϊ20%
C. ƽ��ʱA��Ũ��Ϊ1.50 mol��L��1D. B��ƽ����Ӧ����Ϊ0.2 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����
A.�����ʵ������������������ֱ���ȫȼ�գ����߷ų�������
B.��C(ʯī��s)=C(���ʯ��s) ��H=+1.9kJ/mol��֪�����ʯ��ʯī�ȶ�
C.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l) ��H=��285.8kJ/mol
D.��ϡ��Һ�У�H+(aq)+OH��(aq)=H2O(l) ��H=��57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molKOH����Һ��ϣ��ų�����������57.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء�����˵��������ǣ� ��
A.ʳ���ͺͰƶ�Ӧ�ܷⱣ��
B.���������ۺ��������ķ�Ӧ����������������
C.��Ӱ��ӳʱ�䵽��Ļ�ϵĹ���֤���������ܽ�
D.������ʴ��ʳ�︯�ܡ�����ʯ���γɾ��漰������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú̿������Ϊ�ྻú���õĺ��ļ�������Ӱ��ú����ϵͳЧ�ʡ���Ⱦ�P���������ŷŵĹؼ�����ҵ��������Ҫ��������ʽ������ˮ������CO2�����ʹ�����������Ӧ���£�
i.C(s)+H2O(g)![]() CO(g)+H2(g) ��H=+119kJ��mol-1
CO(g)+H2(g) ��H=+119kJ��mol-1
ii.C(s)+CO2(g)![]() 2CO(g) ��H=+162kJ��mol-1
2CO(g) ��H=+162kJ��mol-1
iii.C(s)+![]() O2(g)
O2(g)![]() CO(g) ��H=-123kJ��mol-1
CO(g) ��H=-123kJ��mol-1
iv.C(s)+ O2(g)![]() CO2(g) ��H=-409kJ��mol-1
CO2(g) ��H=-409kJ��mol-1
(1)����ˮú����ӦCO(g)+H2O(g)![]() H2(g)+CO2(g)����H__��
H2(g)+CO2(g)����H__��
(2)ͼ1�Dz�ͬ������ʽ�õ��ĺϳ����ɷ֣�ͼ2���¶ȶ�̼ת���ʵ�Ӱ��(̼ת������ָ�����õ������е�̼ռ��¯ԭ��ú��̼����������)��
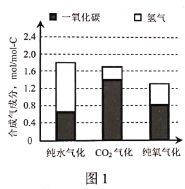
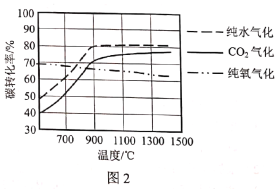
�����������в�ͬ����������Ȼ�Ժϳ����ijɷ���ɺܴ�Ӱ�죬Ϊ����ߺϳ�������̼�ȣ�������Ӧ���ʵ����__���������еı�����
����ʹ�û��������������������������¶���___�����¶����ߴ���������̼ת���ʽ��ͣ�ԭ����___��
�۹�ҵ�ϳ���ѹǿ200kPa�������½���������ѹǿ���߹��Ͷ������������Ľ��У����ܵ�ԭ����__��
��T��ʱ�����ݻ��ɱ�ĺ�ѹ�ܱ������м���20gȼú(��̼84%)��2molH2O(g)ģ�ⴿˮ������Ӧ����ʼ�ݻ�Ϊ2L��һ��ʱ��ﵽƽ����������H2Ϊ1mol������¶���C(s)+H2O(g)![]() CO(g)+H2(g)��ƽ�ⳣ��K=__��
CO(g)+H2(g)��ƽ�ⳣ��K=__��
(3)ú�������п�������CO2��������ʵ��CO2���ۺ����á���ʯī�缫���CO2��CH3CH2OH��ԭ��ʾ��ͼ��ͼ��
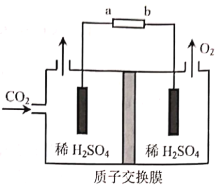
��bΪ��Դ��___(����������������)����
������CH3CH2OH�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ������У���һ�����弫������һ��Һ�壬����������������ʵ�����Σ�ա�����4λͬѧ�ֱ������һ��ʵ�飬ϣ��ͨ���۲쵽������������˵��������̼������������������Һ����Ƶ�װ�����£�
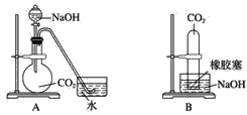
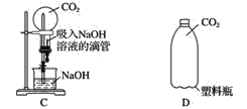
����һλͬѧ�����������̼������ƿD�м�������������Һ���ǽ�ƿ�������������ƿ�ӱ���ˣ�˵��������̼������������Һ�����˷�Ӧ����װ��A��C�����ܴﵽʵ��Ŀ�ĵ�װ�á�����������ʵ�����������±�(�ɲ�����)��
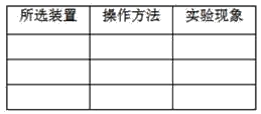
_______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��Ϊ�˲ⶨͭ���Ͻ�������������������ȡͭ���Ͻ���Ʒ20.0 g����80.0 gϡ����ƽ���ֳ�4�ݣ���4�����뵽��Ʒ�У�ÿ�γ�ַ�Ӧ����ʣ������������±�
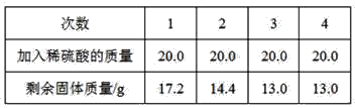
����
(1)20.0 gͭ���Ͻ��У�ͭ��������______��
(2)ͭ���Ͻ��У���Ԫ�ص�����������______��
(3)20 gϡ������Һ������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ܱ������ڣ�SO2������SO3���Ȼ�ѧ����ʽΪ��2SO2(g)+O2(g)![]() 2SO3(g)����H=-akJ��mo1-1 ����ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������
2SO3(g)����H=-akJ��mo1-1 ����ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������
A. 4 mo1SO2��2mol O2
B. 4mol SO2��2mo1 O2��2mol SO3
C. 4mol SO2����4 mo1 O2
D. 6mo1 SO2��4 mo1 O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ֵ���ɫ���壬����ˮ��Ӧ�������ں�����ߺ�DZˮͧ����Ϊ��������Դ�����������ۿ����ʹijЩ��������Ŀ���ֽ⡣����֬�ް�סԼ0.2 g�������Ʒ�ĩ������ʯ�����ϣ�����֬���ϵ�ˮ���ɹ۲쵽��֬����ȼ��������
��ش𣺣�1����ʵ���������ó����йع���������ˮ��Ӧ�Ľ����ǣ�
a�����������ɣ�b.__________��
��2��ij�о���ѧϰС��������ͼ��ʾװ�ý���ʵ�飬��֤���������ۡ�
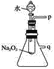
��������֤����a��ʵ�鷽���ǣ�__________��
��������֤����b��ʵ�鷽���ǣ�______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com