
【题目】计算题:(必需写出计算过程)
(1)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L
①求该反应的平衡常数。_____
②在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度。____
(2)利用N2H4(肼)在NO2中燃烧,生成N2、液态H2O,是火箭发射常用的反应之一。已知:N2(g)+2O2(g)=2NO2(g) △H1=+67.2kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol,假如都在相同状态下,请写出发射火箭反应的热化学方程式。(需写出过程)____
【答案】0.25 c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L; 2N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(l) △H=-1135.2kJ/mol
【解析】
根据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到平衡常数的数值;
达到平衡时,测得c(H2)=0.0080mol/L
则 H2 + I2 ![]() 2HI
2HI
起始时各物质的浓度![]() 0.010 0.0100
0.010 0.0100
各物质的浓度变化量![]() 0.00200.00200.0040
0.00200.00200.0040
平衡时各物质的浓度![]() 0.00800.00800.0040
0.00800.00800.0040
(1)该温度下,该反应的平衡常数![]() ;所以该温度下,该反应的平衡常数为0.25,答案:0.25;
;所以该温度下,该反应的平衡常数为0.25,答案:0.25;
(2)在上述温度下该容器中若通入H2和I2蒸气各0.20mol,与上述反应达到相同平衡状态,
则 H2 + I2 ![]() 2HI
2HI![]()
起始时各物质的浓度![]() 0.020 0.020 0
0.020 0.020 0
各物质的浓度变化量![]() x x 2x
x x 2x
平衡时各物质的浓度![]() 0.02-x 0.02-x2X
0.02-x 0.02-x2X
K=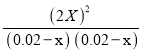 =0.25,解得x=0.004mol/L,所以达到化学平衡状态时各物质的浓度c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L;所以本案:c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L;
=0.25,解得x=0.004mol/L,所以达到化学平衡状态时各物质的浓度c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L;所以本案:c(HI)=0.008mol/L,c(H2)=0.016mol/L;C(I2)=0.016mol/L;
(2)N2(g)+2O2(g) ![]() 2NO2(g) △H=+67.2KJ/mol ①
2NO2(g) △H=+67.2KJ/mol ①
N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) △H=-534KJ/mol ②
N2(g)+2H2O(g) △H=-534KJ/mol ②
由盖斯定律②-①![]() 1/2得到: N2H4(g)+ NO2(g)=3/2N2(g)+4H2O(l) △H=-567.6kJ/mol
1/2得到: N2H4(g)+ NO2(g)=3/2N2(g)+4H2O(l) △H=-567.6kJ/mol
,所以火箭燃烧的热化学反应方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.2kJ/mol;
因此,本题正确答案是: 2N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(l) △H=-1135.2kJ/mol


科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlN具有耐高温、导热性好等优点,可溶于浓的NaOH溶液。一定条件下可通过反应Al2O3+N2+3C=2AlN+3CO合成。下列叙述正确的是( )
A.反应中N2是还原剂
B.AlN可作耐高温材料
C.每生成1 mol AlN,有3mol电子转移
D.产物AlN中混有的Al2O3可用浓的NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)ΔH=__kJ/mol。
CH3OH(g)+H2O(l)ΔH=__kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。
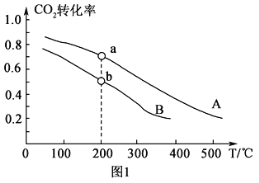
其中a点的平衡常数表达式为:__。
②a,b两点化学反应速率分别用Va、Vb表示,则Va__Vb(填“大于”、“小于”或“等于”)。
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。

A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g)![]() CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
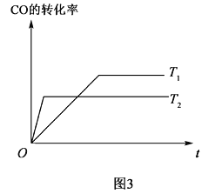
①该反应的焓变ΔH__0(填“ ”、“ ”或“ ”)。
②T1和T2温度下的平衡常数大小关系是K1___K2(填“>”、“<”或“=”)。
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为___。
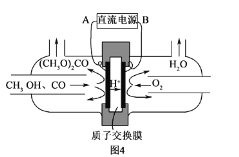
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4 和极少量的PbO2)和稀H2SO4 为原料制备高纯PbO 的工艺流程如下:
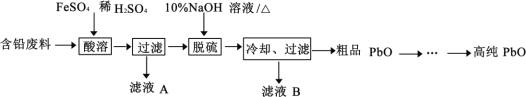
(1)铅蓄电池放电时负极的电极反应________。
(2)酸溶过程中含铅废料需要粉碎,其目的是__________,在 Fe2+催化下,PbO2 和Pb 反应生成PbSO4,生成 1molPbSO4 转移电子的物质的量__________mol。
(3)滤液A 中含有的主要阳离子是______(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为______。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是______
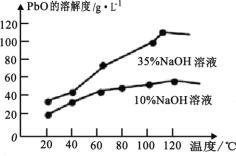
(6)PbO 溶解在NaOH 溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200 ℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+![]() O2(g)===SO2(g)+H2O(g) ΔH1,2H2S(g)+SO2(g)===
O2(g)===SO2(g)+H2O(g) ΔH1,2H2S(g)+SO2(g)===![]() S2(g)+2H2O(g) ΔH2,H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3,2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( )
S2(g)+2H2O(g) ΔH2,H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3,2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( )
A. ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B. ΔH4=
(ΔH1+ΔH2-3ΔH3)B. ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C. ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D. ΔH4=
(ΔH1+ΔH2-3ΔH3)D. ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体常用做农业和渔业的杀虫剂、杀菌剂。实验室模拟由废铜屑(含少量铁)生产硫酸铜晶体的流程如图:
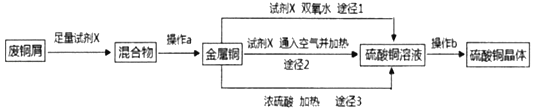
(1)试剂X是_____,操作a需要的玻璃仪器有烧杯、玻璃棒和_____。
(2)途径1是将铜加入到试剂X与双氧水的混和液中并用30~40℃水浴加热,该过程中温度不宜过高的原因是_____。
(3)途径2是将铜加入到试剂X中,再通入足量的空气并加热,该反应的化学方程式为_____。
(4)从环保和经济的角度对比途径1与途径3,途径1的优点有_____、_____。
(5)操作b包括蒸发浓缩、_____、过滤、冼涤、干燥(请补全缺少的实验步骤)。
(6)硫酸铜晶体(CuSO4xH2O)中结晶水数目可通过以下实验测定:
Ⅰ.称取4.6400g样品置于小烧杯中,加入适量水溶解,边搅拌边滴加BaCl2溶液到沉淀完全
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为4.6600g。计算CuSO4xH2O中的x值(要求写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
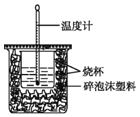
(1)该图中有一处未画出,它是_______填仪器名称)。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则根据此实验的数据书写中和热的热化学方程式中的H将____(填“偏大”“偏小”或“不变”),原因是_______。
(4)利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,设溶液的密度均为1 g/cm3,中和后溶液的比热容c=4.18 J/(g·℃),请根据实验数据计算中和热H= __ (取小数点后一位)。
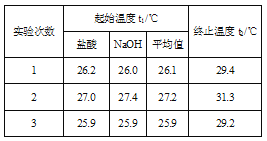
(5)上述(4)中的结果与中和热的理论值有偏差,产生偏差的原因可能是___。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物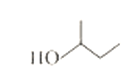 系统命名法命名为______________;2,3-二甲基-1-戊烯的结构简式____;
系统命名法命名为______________;2,3-二甲基-1-戊烯的结构简式____;
(2)写出甲苯制TNT的化学方程式:_________________
(3)写出1,2-二氯乙烷发生消去反应的方程式:___________
(4)下列卤代烃在强碱的醇溶液中加热不反应的有________________;
①![]() ②(CH3)3CCH2Cl ③(CH3)3CBr ④CHCl2CHBr2 ⑤
②(CH3)3CCH2Cl ③(CH3)3CBr ④CHCl2CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
(5)有机物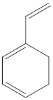 与等物质的量的Br2发生加成反应产物有_________种;
与等物质的量的Br2发生加成反应产物有_________种;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com