
【题目】AlN具有耐高温、导热性好等优点,可溶于浓的NaOH溶液。一定条件下可通过反应Al2O3+N2+3C=2AlN+3CO合成。下列叙述正确的是( )
A.反应中N2是还原剂
B.AlN可作耐高温材料
C.每生成1 mol AlN,有3mol电子转移
D.产物AlN中混有的Al2O3可用浓的NaOH溶液除去
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医疗上常用作补血剂。某课外活动小组为测定该补血剂中铁元素的含量,设计如下实验。
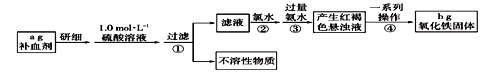
(1)实验时用18.4 mol·L-1的浓硫酸配制100mL1.0 mol·L-1的硫酸溶液,所需浓硫酸的体积为______mL(保留一位小数)。
(2)步骤①过滤后的滤液中加入氯水后发生反应的离子方程式为__________________________。
(3)向滤液中直接加入过量氨水时,生成的白色沉淀迅速变为灰绿色,最后变为红褐色,沉淀颜色变化的原因用化学方程式表示为_______________________。
(4)该补血剂中铁元素的质量分数为____________,若步骤③加入氨水的量不足,则实验结果_____(填“偏大”、“偏小”、“无影响”)
(5)科学研究表明服用含硫酸亚铁的补血剂时,同时服用维生素C有利于铁元素的吸收。则维生素C在其过程中的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:
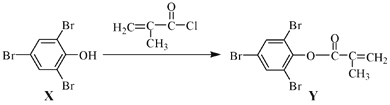
下列有关化合物X、Y 的说法正确的是( )
A.X 分子中所有原子一定在同一平面上B.X、Y均不能使酸性KMnO4溶液褪色
C.Y与Br2的加成产物分子中含有手性碳原子D.X→Y的反应为加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是

A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
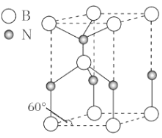
【题目】离子液体是在室温和室温附近温度下呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。如图为某离子液体的结构,回答下列问题:
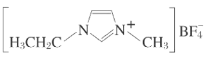
(1)B原子核外有___种运动状态不同的电子。BF4-中,B原子价层电子对数为___,与BF4-互为等电子体的分子为___(填分子式,写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是___,它们性质相似的原因是___。
(2)NH3极易溶于水的原因与氢键有关,结合NH3·H2O的电离推测NH3·H2O的合理结构式为___(填字母)。
A.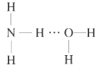 B.
B.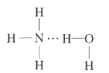 C.
C.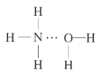 D.
D.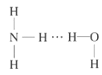
(3)该离子液体常温下为液体,而NaBF4常温下为固体,原因是___。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则该离子液体的阳离子中存在一个大π键,可表示为___。
),则该离子液体的阳离子中存在一个大π键,可表示为___。
(5)某硼的含氧酸根离子为无限链状结构,节选部分结构如图所示,其离子的化学式可用通式表示为___(用n代表B原子数)。
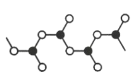
(6)某种含B和N两种元素的功能陶瓷,其晶胞结构如图所示。已知该晶胞底面为菱形,其边长为acm,高为bcm,晶体密度为ρg/cm3,则阿伏加德罗常数NA为___mol-1(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成NH3所需的H2可由煤与H2O反应制得,其中有一步反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>O,欲提高CO转化率可采用的方法可能有①降低温度②增大压强③使用催化剂④增大CO的浓度⑤增大水蒸气的浓度,其中正确的组合是( )
CO2(g)+H2(g) △H>O,欲提高CO转化率可采用的方法可能有①降低温度②增大压强③使用催化剂④增大CO的浓度⑤增大水蒸气的浓度,其中正确的组合是( )
A. ①②③B. ④⑤C. ①⑤D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.2molB. 1.6molC. 2.4molD. 2.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算题:(必需写出计算过程)
(1)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L
①求该反应的平衡常数。_____
②在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度。____
(2)利用N2H4(肼)在NO2中燃烧,生成N2、液态H2O,是火箭发射常用的反应之一。已知:N2(g)+2O2(g)=2NO2(g) △H1=+67.2kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol,假如都在相同状态下,请写出发射火箭反应的热化学方程式。(需写出过程)____
查看答案和解析>>
科目:高中化学 来源: 题型:
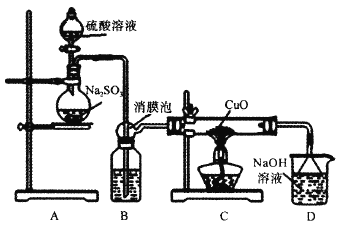
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:
Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为___,消膜泡的作用是__。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为____(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值____(填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com