
【题目】离子液体是在室温和室温附近温度下呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。如图为某离子液体的结构,回答下列问题:
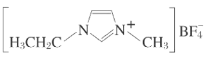
(1)B原子核外有___种运动状态不同的电子。BF4-中,B原子价层电子对数为___,与BF4-互为等电子体的分子为___(填分子式,写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是___,它们性质相似的原因是___。
(2)NH3极易溶于水的原因与氢键有关,结合NH3·H2O的电离推测NH3·H2O的合理结构式为___(填字母)。
A.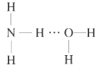 B.
B.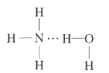 C.
C.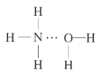 D.
D.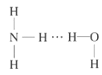
(3)该离子液体常温下为液体,而NaBF4常温下为固体,原因是___。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则该离子液体的阳离子中存在一个大π键,可表示为___。
),则该离子液体的阳离子中存在一个大π键,可表示为___。
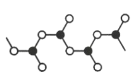
(5)某硼的含氧酸根离子为无限链状结构,节选部分结构如图所示,其离子的化学式可用通式表示为___(用n代表B原子数)。
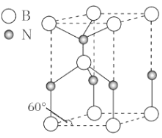
(6)某种含B和N两种元素的功能陶瓷,其晶胞结构如图所示。已知该晶胞底面为菱形,其边长为acm,高为bcm,晶体密度为ρg/cm3,则阿伏加德罗常数NA为___mol-1(列出计算式)。
【答案】5 4 CCl4或SiF4 Si 电负性相近 B 均为离子晶体,NaBF4的晶格能大,所以熔点高 ![]() (BO2)nn-或(BnO2n)n-
(BO2)nn-或(BnO2n)n- ![]() 或
或![]()
【解析】
(1)B为5号元素;根据价层电子对个数=σ键个数+孤电子对个数计算BF4-中B原子价层电子对数;结合等电子体的概念分析解答;根据对角线规则分析解答;
(2)根据NH3·H2O![]() NH4++OH-推测NH3·H2O的合理结构;
NH4++OH-推测NH3·H2O的合理结构;
(3)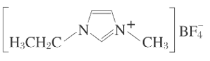 和NaBF4均为离子晶体,结合晶格能的大小与熔沸点的关系分析解答;
和NaBF4均为离子晶体,结合晶格能的大小与熔沸点的关系分析解答;
(4) 的环中的大π键由3个碳原子和2个N原子,每个C有1个电子参与形成大π键,每个N有2个电子参与形成大π键,环带有一个单位正电荷,据此分析判断;
的环中的大π键由3个碳原子和2个N原子,每个C有1个电子参与形成大π键,每个N有2个电子参与形成大π键,环带有一个单位正电荷,据此分析判断;
(5)根据图示,黑球表示B原子,白球表示O原子,根据均摊法计算判断结构中B原子和O原子的数目比,以图示4个B原子为例,要满足O原子的8电子稳定结构,需要带4个单位负电荷,据此书写该离子的化学式的通式;
(6)根据均摊法计算晶胞中含有B和N原子数,再计算晶胞的质量和晶胞的体积,结合晶体密度的计算方法列式计算。
(1)B为5号元素,原子核外有5种运动状态不同的电子;BF4-中,B原子价层电子对数为4+![]() =4,与BF4-互为等电子体的分子为CCl4或SiF4或CF4或SiCl4;根据对角线规则,在周期表中,与B的化学性质最相似的邻族元素是Si,它们性质相似,是因为电负性相近,故答案为:5;4;CCl4或SiF4或CF4或SiCl4;Si;电负性相近;
=4,与BF4-互为等电子体的分子为CCl4或SiF4或CF4或SiCl4;根据对角线规则,在周期表中,与B的化学性质最相似的邻族元素是Si,它们性质相似,是因为电负性相近,故答案为:5;4;CCl4或SiF4或CF4或SiCl4;Si;电负性相近;
(2)NH3极易溶于水的原因与氢键有关,根据NH3·H2O![]() NH4++OH-,可以推测NH3·H2O的合理结构式为
NH4++OH-,可以推测NH3·H2O的合理结构式为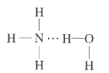 ,故答案为:B;
,故答案为:B;
(3) 和NaBF4均为离子晶体,
和NaBF4均为离子晶体, 常温下为液体,而NaBF4常温下为固体,是因为NaBF4的晶格能大,使得熔点NaBF4比
常温下为液体,而NaBF4常温下为固体,是因为NaBF4的晶格能大,使得熔点NaBF4比 高,故答案为:均为离子晶体,NaBF4的晶格能大,所以熔点高;
高,故答案为:均为离子晶体,NaBF4的晶格能大,所以熔点高;
(4) 的环中的大π键由3个碳原子和2个N原子、每个C形成3个σ键,有1个电子参与形成大π键,每个N形成3个σ键,有2个电子参与形成大π键,环带有一个单位正电荷,共6个电子参与形成大π键,该大π键可表示为
的环中的大π键由3个碳原子和2个N原子、每个C形成3个σ键,有1个电子参与形成大π键,每个N形成3个σ键,有2个电子参与形成大π键,环带有一个单位正电荷,共6个电子参与形成大π键,该大π键可表示为![]() ,故答案为:
,故答案为:![]() ;
;
(5)某硼的含氧酸根离子为无限链状结构,根据图示,黑球表示B原子,白球表示O原子,结构中BO3结构单元通过氧原子连接形成链状结构,则B原子和O原子的数目比=1∶(2×![]() +1)=1∶2,以图示4个B原子为例,要满足O原子的8电子稳定结构,需要带4个单位负电荷,因此该离子的化学式可用通式(BO2)nn-或(BnO2n)n-表示,故答案为:(BO2)nn-或(BnO2n)n-;
+1)=1∶2,以图示4个B原子为例,要满足O原子的8电子稳定结构,需要带4个单位负电荷,因此该离子的化学式可用通式(BO2)nn-或(BnO2n)n-表示,故答案为:(BO2)nn-或(BnO2n)n-;
(6)根据图示,晶胞中含有B原子数为4×![]() +4×
+4×![]() +1=2,N原子数为2×
+1=2,N原子数为2×![]() +2×
+2×![]() +1=2,因此晶胞的质量为
+1=2,因此晶胞的质量为![]() g,晶胞的体积为
g,晶胞的体积为![]() =
=![]() cm3,则晶体密度ρg/cm3=
cm3,则晶体密度ρg/cm3=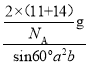 =
=![]() g/cm3,则NA=
g/cm3,则NA=![]() =
=![]() ,故答案为:
,故答案为:![]() 或
或![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(C1O2)是易溶于水且不与水反应的黄绿色气体,沸点为11℃。某小组在实验室中制备C1O2的装置如下:[已知:SO2+2NaC1O3+H2SO4=2C1O2+2NaHSO4]
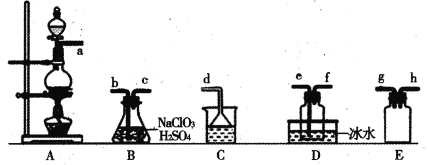
下列说法正确的是
A.连接装置时,导管口a应接h或g,导管口c应接e
B.装置C中装的是饱和食盐水,导管口a通过的气体为SO2
C.装置D放冰水的目的是液化SO2,防止污染环境
D.可选用装置A,用1 mol·L-1盐酸与MnO2反应制取Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A. 该固体中一定含有NH4+、CO32-、SO42-、Na+ B. 该固体中一定没有Cu2+、Cl-、Na+
C. 该固体中只含有NH4+、CO32-、SO42-、Cl- D. 根据以上实验,无法确定该固体中有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1L0.1mol/L的Na2CO3溶液中含阴离子总数为0.1NA
B.7.8gNa2O2与过量CO2反应时,转移的电子数为0.2NA
C.2gH218O与D216O的混合物中所含的中子数和电子数均为NA
D.足量乙烷与22.4L(标准状况)Cl2发生取代反应,形成C-Cl键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数的描述中正确的是( )
A. 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B. 相同温度下,反应A+BC与反应CA+B的化学平衡常数相同
C. 反应2SO2(g)+O2(g)2SO3(g) ΔH<0的化学平衡常数随温度升高而增大
D. 反应A(g)+B(g)2C(g)的平衡常数表达式为K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlN具有耐高温、导热性好等优点,可溶于浓的NaOH溶液。一定条件下可通过反应Al2O3+N2+3C=2AlN+3CO合成。下列叙述正确的是( )
A.反应中N2是还原剂
B.AlN可作耐高温材料
C.每生成1 mol AlN,有3mol电子转移
D.产物AlN中混有的Al2O3可用浓的NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
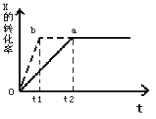
A. 降低温度B. 增大Y的浓度
C. 加入催化剂D. 增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4 和极少量的PbO2)和稀H2SO4 为原料制备高纯PbO 的工艺流程如下:
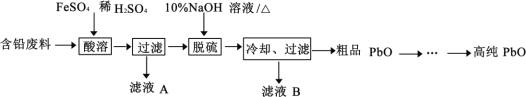
(1)铅蓄电池放电时负极的电极反应________。
(2)酸溶过程中含铅废料需要粉碎,其目的是__________,在 Fe2+催化下,PbO2 和Pb 反应生成PbSO4,生成 1molPbSO4 转移电子的物质的量__________mol。
(3)滤液A 中含有的主要阳离子是______(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为______。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是______
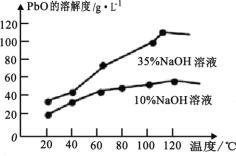
(6)PbO 溶解在NaOH 溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程表达式中,属于电离方程式的是( )
A. HSO3-+H3O+![]() H2SO3+H2OB. NH3·H2O
H2SO3+H2OB. NH3·H2O![]() NH4++OH-
NH4++OH-
C. CH3COO-+H2O![]() CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com