
【题目】下列过程表达式中,属于电离方程式的是( )
A. HSO3-+H3O+![]() H2SO3+H2OB. NH3·H2O
H2SO3+H2OB. NH3·H2O![]() NH4++OH-
NH4++OH-
C. CH3COO-+H2O![]() CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
【答案】B
【解析】
酸、碱、盐溶于水时发生电离,此过程用电离方程式表示,书写电离方程式时应先判断电解质的强弱。如为强电解质则在水中完全电离,用“=”连接,若为弱电解质则在水中部分电离,用“![]() ”连接。同时等式两边应遵循质量守恒定律,即左右两边同种元素的原子个数相等。溶液之所以不显电性,是因为阳离子所带的正电总数和阴离子所带的负电荷总数相等,电离时原子团一般不拆分。
”连接。同时等式两边应遵循质量守恒定律,即左右两边同种元素的原子个数相等。溶液之所以不显电性,是因为阳离子所带的正电总数和阴离子所带的负电荷总数相等,电离时原子团一般不拆分。
A. HSO3-+H3O+![]() H2SO3+H2O,此式可表示为HSO3-+H+
H2SO3+H2O,此式可表示为HSO3-+H+![]() H2SO3,不是电离方程式,A项错误;
H2SO3,不是电离方程式,A项错误;
B. NH3·H2O![]() NH4++OH-,表示NH3·H2O 为弱电解质,发生部分电离,B项正确;
NH4++OH-,表示NH3·H2O 为弱电解质,发生部分电离,B项正确;
C. CH3COO-+H2O![]() CH3COOH+OH-,表示CH3COO-在水中发生水解反应,不是电离方程式,C项错误;
CH3COOH+OH-,表示CH3COO-在水中发生水解反应,不是电离方程式,C项错误;
D. HCO3-+OH-=H2O+CO32-,表示酸式盐与碱反应生成正盐和水,不是电离方程式,D项错误;
答案应选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】离子液体是在室温和室温附近温度下呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。如图为某离子液体的结构,回答下列问题:
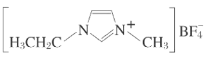
(1)B原子核外有___种运动状态不同的电子。BF4-中,B原子价层电子对数为___,与BF4-互为等电子体的分子为___(填分子式,写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是___,它们性质相似的原因是___。
(2)NH3极易溶于水的原因与氢键有关,结合NH3·H2O的电离推测NH3·H2O的合理结构式为___(填字母)。
A.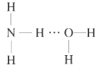 B.
B.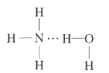 C.
C.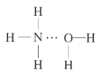 D.
D.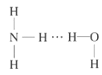
(3)该离子液体常温下为液体,而NaBF4常温下为固体,原因是___。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则该离子液体的阳离子中存在一个大π键,可表示为___。
),则该离子液体的阳离子中存在一个大π键,可表示为___。
(5)某硼的含氧酸根离子为无限链状结构,节选部分结构如图所示,其离子的化学式可用通式表示为___(用n代表B原子数)。
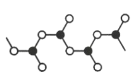
(6)某种含B和N两种元素的功能陶瓷,其晶胞结构如图所示。已知该晶胞底面为菱形,其边长为acm,高为bcm,晶体密度为ρg/cm3,则阿伏加德罗常数NA为___mol-1(列出计算式)。
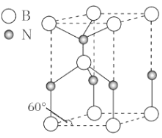
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 H、B、C、N、O、F 等元素通过共价键形成的物质在工业生产中有广泛的应用。回答下列问题:
(1)氧原子核外有_____种不同运动状态的电子,有_______ 种不同能量的原子轨道。
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为______。
(3)C2H4 与N2H4 在水中的溶解度相差很大, 出现这种现象的主要原因是 __________。
(4)H2C2O4 分子中碳原子的杂化类型是 _________,写出一种与 C2O42-互为等电子体的分子的化学式_______________。
(5)NaHF2 可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2 中所含作用力的类型有___________(填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为______在其晶胞(图Ⅱ所示)中层内 BN 核间距为 apm,层间 BN 核间距为bpm,其密度为______g·cm -3(阿伏加德罗常数的值为 NA,用含 a、b、NA 的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,甘氨酸在水溶液中主要以 、
、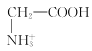 和
和![]() 三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
三种微粒形式存在,实验测得不同pH甘氨酸溶液中各成分分布分数δ与pH关系如图所示。下列说法正确的是( )
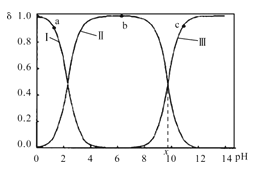
A.a点溶液中,水的电离程度大于b点
B.c点溶液中,c(![]() )>c(
)>c( )
)
C.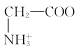 +H2O
+H2O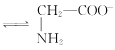 +H3O+的平衡常数为x
+H3O+的平衡常数为x
D.a点溶液中,存在关系式:c(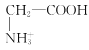 )+c(H+)=c(
)+c(H+)=c(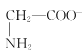 )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:
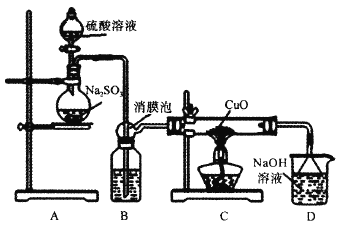
Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为___,消膜泡的作用是__。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为____(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值____(填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 与
与![]() 互为同位素
互为同位素
B.O2和O3互为同素异形体,两者之间不能相互转化
C.乙醇和甲醚互为同分异构体,可用金属钠鉴别
D.![]() 的一氯代物只有2种(不考虑立体异构)
的一氯代物只有2种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚有下列说法:

①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③该化合物可以发生取代反应、加成反应、加聚反应、氧化反应
④![]() 该化合物最多可与4mol H2或1molBr2发生加成反应。其中正确的是( )
该化合物最多可与4mol H2或1molBr2发生加成反应。其中正确的是( )
A. ①③B. ①②④C. ②③D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法中正确的是( )
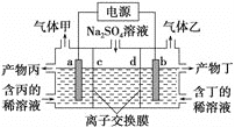
A. a极与电源的负极相连
B. 产物丁为硫酸溶液
C. 离子交换膜d为阳离子交换膜
D. b电极反应式:4OH--4e- =O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com