
【题目】由 H、B、C、N、O、F 等元素通过共价键形成的物质在工业生产中有广泛的应用。回答下列问题:
(1)氧原子核外有_____种不同运动状态的电子,有_______ 种不同能量的原子轨道。
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为______。
(3)C2H4 与N2H4 在水中的溶解度相差很大, 出现这种现象的主要原因是 __________。
(4)H2C2O4 分子中碳原子的杂化类型是 _________,写出一种与 C2O42-互为等电子体的分子的化学式_______________。
(5)NaHF2 可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2 中所含作用力的类型有___________(填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为______在其晶胞(图Ⅱ所示)中层内 BN 核间距为 apm,层间 BN 核间距为bpm,其密度为______g·cm -3(阿伏加德罗常数的值为 NA,用含 a、b、NA 的代数式表示)

【答案】8 3 ![]() C2H4 与H2O 之间无氢键,N2H4 与H2O 之间有氢键存在 sp2 N2O4(或其他合理答案) abd BN
C2H4 与H2O 之间无氢键,N2H4 与H2O 之间有氢键存在 sp2 N2O4(或其他合理答案) abd BN 
【解析】
(1)核外没有运动状态相同的电子;有1s轨道、2s轨道、3个能量相同的2p轨道;
(2)N 原子外围电子排布式为:2s22p3,Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,则Bi原子外围电子排布式为:6s26p3,以此写出基态 Bi 原子的价电子轨道排布图;
(3)N2H4 与H2O 之间有氢键存在;
(4)根据价层电子对互斥理论分析H2C2O4 分子中碳原子的杂化类型;C2O42-含有46个电子;
(5)NaHF2中含有离子键、共价键,F的电负性较强,还存在氢键;
(6)利用均摊法计算晶胞中N原子和B原子数目,以此写出化学式;而晶胞密度![]() 联立计算。
联立计算。
(1)氧原子核外有8个电子,核外没有运动状态相同的电子,则有8种不同运动状态的电子;有1s轨道、2s轨道、3个能量相同的2p轨道,共三种不同能量的原子轨道,故答案为:8;3;
(2)N 原子外围电子排布式为:2s22p3,Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,则Bi原子外围电子排布式为:6s26p3,则基态 Bi 原子的价电子轨道排布图为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)C2H4 与H2O 之间无氢键,N2H4 与H2O 之间有氢键存在,则N2H4在水中的溶解度比C2H4在水中溶解度大,故答案为:C2H4 与H2O 之间无氢键,N2H4 与H2O 之间有氢键存在;
(4)H2C2O4 分子中碳原子含有3个σ键,无孤电子对,则H2C2O4 分子中碳原子的杂化类型是sp2;C2O42-含有46个电子,与 C2O42-互为等电子体的分子的化学式有N2O4,故答案为sp2;N2O4(或其他合理答案);
(5)NaHF2中含有离子键、共价键,F的电负性较强,还存在氢键,故答案为:abd;
(6)晶胞中N原子个数为![]() ,B原子数目为:
,B原子数目为:![]() ,氮化硼的化学式为BN;晶胞质量
,氮化硼的化学式为BN;晶胞质量![]() ,晶胞体积
,晶胞体积![]() 晶胞密度
晶胞密度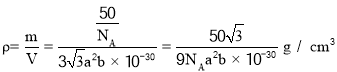 ,故答案为:BN;
,故答案为:BN;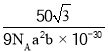 。
。


科目:高中化学 来源: 题型:
【题目】某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A. 该固体中一定含有NH4+、CO32-、SO42-、Na+ B. 该固体中一定没有Cu2+、Cl-、Na+
C. 该固体中只含有NH4+、CO32-、SO42-、Cl- D. 根据以上实验,无法确定该固体中有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
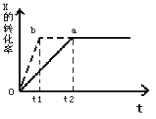
A. 降低温度B. 增大Y的浓度
C. 加入催化剂D. 增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4 和极少量的PbO2)和稀H2SO4 为原料制备高纯PbO 的工艺流程如下:
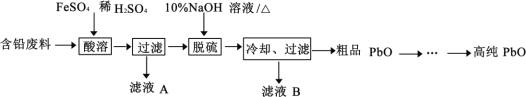
(1)铅蓄电池放电时负极的电极反应________。
(2)酸溶过程中含铅废料需要粉碎,其目的是__________,在 Fe2+催化下,PbO2 和Pb 反应生成PbSO4,生成 1molPbSO4 转移电子的物质的量__________mol。
(3)滤液A 中含有的主要阳离子是______(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为______。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是______
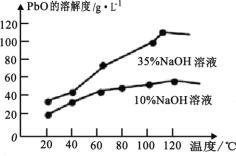
(6)PbO 溶解在NaOH 溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业废气和汽车尾气中含有多种氮氧化物,氮氧化物能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。
(1)处理 NO 尾气通常是将 NO 与 O2 混合通入碱液中吸收。已知一定条件下有下列反应:
Ⅰ:2N2O5(g) ![]() 4NO2(g)+O2(g) △H1
4NO2(g)+O2(g) △H1
Ⅱ:2NO2(g)![]() 2NO(g)+O2(g) △H2
2NO(g)+O2(g) △H2
Ⅲ:2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) △H3
写出 NO 和O2 的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式______。
(2)常温下,NO 极易被 O2 氧化为 NO2,温度高于 423K 时,NO2 发生分解:2NO2(g) ![]() 2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
υ正=υ(NO2)消耗=k 正C2(NO2), υ逆=υ(NO)消耗=2υ(O2) 消耗=k 逆c2(NO)·c( O2),k 正、k 逆 为速率常数,受温度影响。不同温度下,将 NO2 置于体积为 VL 的密闭容器中,NO2 的物质的量的浓度与反应时间的关系如图所示:
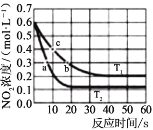
①T1 温度下 0-10s 内,O2 的反应速率υ(O2)=______、平衡常数 KT1=___________。
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采取的单一措施有______
③平衡常数KT1 ______ KT2 填“大于”“小于”或“等于”,下同);反应速率υa_______υb。
④计算 c 处υ正/υ逆=______。
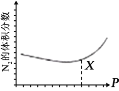
(3)NO 也 可 通 过 如 下 反 应 处 理 :6NO(g)+4NH3(g) =5N2(g) +6H2O(g);一定条件下,平衡时 N2 的体积分数与压强的关系如图所示。N2 的体积分数先减小后增大的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体常用做农业和渔业的杀虫剂、杀菌剂。实验室模拟由废铜屑(含少量铁)生产硫酸铜晶体的流程如图:
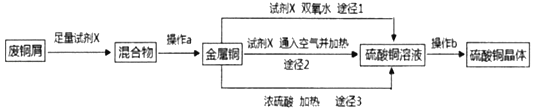
(1)试剂X是_____,操作a需要的玻璃仪器有烧杯、玻璃棒和_____。
(2)途径1是将铜加入到试剂X与双氧水的混和液中并用30~40℃水浴加热,该过程中温度不宜过高的原因是_____。
(3)途径2是将铜加入到试剂X中,再通入足量的空气并加热,该反应的化学方程式为_____。
(4)从环保和经济的角度对比途径1与途径3,途径1的优点有_____、_____。
(5)操作b包括蒸发浓缩、_____、过滤、冼涤、干燥(请补全缺少的实验步骤)。
(6)硫酸铜晶体(CuSO4xH2O)中结晶水数目可通过以下实验测定:
Ⅰ.称取4.6400g样品置于小烧杯中,加入适量水溶解,边搅拌边滴加BaCl2溶液到沉淀完全
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为4.6600g。计算CuSO4xH2O中的x值(要求写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,原子最外层电子数之和为17。其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
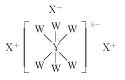
A.原子半径:Z>Y>X>W
B.X与Z形成的化合物会抑制水的电离
C.X、Z均能形成两种常见氧化物
D.W的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程表达式中,属于电离方程式的是( )
A. HSO3-+H3O+![]() H2SO3+H2OB. NH3·H2O
H2SO3+H2OB. NH3·H2O![]() NH4++OH-
NH4++OH-
C. CH3COO-+H2O![]() CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出OA段和BC段反应的离子方程式:
OA:___________ ; BC:_____________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com