
【题目】图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
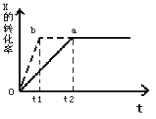
A. 降低温度B. 增大Y的浓度
C. 加入催化剂D. 增大体系压强
科目:高中化学 来源: 题型:
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质的结构式为________,二氯胺与水反应的化学方程式为_____________。将0.01 mol NCl3通入100 mL 0.5 mol/L Na2SO3溶液中,转移电子的物质的量为_______mol。
(2)已知部分化学键的键能和化学反应的能量变化如下表和下图所示。
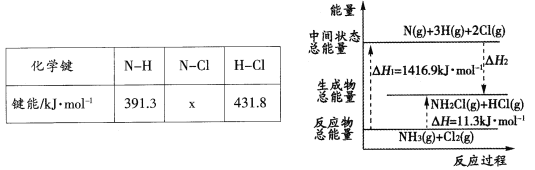
则反应过程中的△H2=____kJ·mol-1,表中的x=_____。
(3)在密闭容器中反应NH3(g)+Cl2(g)![]() NH2Cl(g)+HCl(g)达到平衡,通过热力学定律计算,不同温度下理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,通过热力学定律计算,不同温度下理论上NH2Cl的体积分数随![]() 的变化如下图所示。
的变化如下图所示。
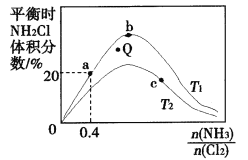
①a、b、c三点对应平衡常数的大小关系是(分别用Ka、Kb、Kc表示)_________。b点时,该反应的平衡常数为________;
②T2℃,Q点对应的速率:![]() __________
__________![]() (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
③在氨氯比一定时,提高NH3的转化率的方法是__________(任写1种);
④若产物都是气体,实验测得NH2C1的体积分数始终比理论值低,原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。(已知反应:I2+2S2O32-=2I-+S4O62-)计算该水样中的溶解氧(以mg·L1表示),写出计算过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是在室温和室温附近温度下呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。如图为某离子液体的结构,回答下列问题:
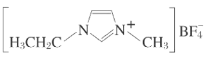
(1)B原子核外有___种运动状态不同的电子。BF4-中,B原子价层电子对数为___,与BF4-互为等电子体的分子为___(填分子式,写出一种即可);在周期表中,与B的化学性质最相似的邻族元素是___,它们性质相似的原因是___。
(2)NH3极易溶于水的原因与氢键有关,结合NH3·H2O的电离推测NH3·H2O的合理结构式为___(填字母)。
A.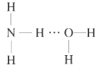 B.
B.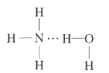 C.
C.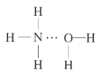 D.
D.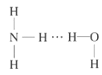
(3)该离子液体常温下为液体,而NaBF4常温下为固体,原因是___。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则该离子液体的阳离子中存在一个大π键,可表示为___。
),则该离子液体的阳离子中存在一个大π键,可表示为___。
(5)某硼的含氧酸根离子为无限链状结构,节选部分结构如图所示,其离子的化学式可用通式表示为___(用n代表B原子数)。
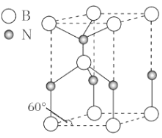
(6)某种含B和N两种元素的功能陶瓷,其晶胞结构如图所示。已知该晶胞底面为菱形,其边长为acm,高为bcm,晶体密度为ρg/cm3,则阿伏加德罗常数NA为___mol-1(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒沙特列原理解释的是( )
A. Fe(SCN)3溶液中加入固体KSCN后颜色变深
B. 棕红色NO2加压后颜色先变深后变浅
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. 高压比常压有利于NH3的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.2molB. 1.6molC. 2.4molD. 2.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1)铜原子核外电子共有__种不同运动状态,基态铜原子的核外占据最高能层电子的电子云轮廓图形状为__。
(2)根据铜、锌原子结构可知第二电离能I2(Zn)__I2(Cu)填“大于”或“小于” 。
(3)向蓝色硫酸铜溶液[Cu(H2O)4]2+中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。
①H2O分子中心原子的杂化类型为__;分子中的键角:H2O__NH3(填“大于”或“小于”)。
②通过上述实验现象可知,与Cu2+的配位能力:H2O__NH3(填“大于”或“小于”)。
③氨硼烷(BH3—NH3)可以作为机动车使用的备选氢来源或氢储存的材料。
下列与氨硼烷是等电子体的有__(填编号)。
A.乙烷 B.H2O2 C.H3PO4 D.S8
④写出BH3—NH3的结构式 结构中若含配位键用→表示 __。
(4)某磷青铜晶胞结构如图所示。
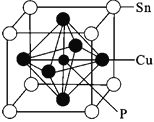
①其化学式为__。
②若晶体密度为8.82g/cm3,最近的Cu原子核间距为__cm(用NA表示阿伏加德罗常数,用M表示该晶体的摩尔质量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 H、B、C、N、O、F 等元素通过共价键形成的物质在工业生产中有广泛的应用。回答下列问题:
(1)氧原子核外有_____种不同运动状态的电子,有_______ 种不同能量的原子轨道。
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为______。
(3)C2H4 与N2H4 在水中的溶解度相差很大, 出现这种现象的主要原因是 __________。
(4)H2C2O4 分子中碳原子的杂化类型是 _________,写出一种与 C2O42-互为等电子体的分子的化学式_______________。
(5)NaHF2 可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2 中所含作用力的类型有___________(填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为______在其晶胞(图Ⅱ所示)中层内 BN 核间距为 apm,层间 BN 核间距为bpm,其密度为______g·cm -3(阿伏加德罗常数的值为 NA,用含 a、b、NA 的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 与
与![]() 互为同位素
互为同位素
B.O2和O3互为同素异形体,两者之间不能相互转化
C.乙醇和甲醚互为同分异构体,可用金属钠鉴别
D.![]() 的一氯代物只有2种(不考虑立体异构)
的一氯代物只有2种(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com