
【题目】下列不能用勒沙特列原理解释的是( )
A. Fe(SCN)3溶液中加入固体KSCN后颜色变深
B. 棕红色NO2加压后颜色先变深后变浅
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. 高压比常压有利于NH3的合成
科目:高中化学 来源: 题型:
【题目】某科学兴趣小组查阅资料得知,反应温度不同,氢气还原氧化铜的产物就不同,可能是Cu或Cu2O,Cu和Cu2O均为不溶于水的红色固体,但Cu2O能与稀硫酸发生反应:Cu2O+H2SO4=CuSO4+Cu+H2O。为探究反应后的红色固体的成分,他们提出了以下假设:
假设一:红色固体只有Cu
假设二:红色固体只有Cu2O
假设三:红色固体中有Cu和Cu2O
下列判断正确的是
A.取少量红色固体,加入足量的稀硫酸,若溶液无明显现象,则假设一和二都成立
B.少量红色固体与足量稀硫酸反应,若溶液呈蓝色且仍有红色固体,则只有假设三成立
C.若将7.2克红色固体通入足量的H2还原,最后得到固体6.4克,则假设二成立
D.实验室可用向新制Cu(OH)2悬浊液(碱性)中加入葡萄糖后加热,来制取Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3(183℃升华)遇潮湿空气即变质,同时产生大量白雾,实验室可用下列装置制备。

(1)反应前,装置A中盛放浓盐酸的仪器名称是_____。
(2)反应时,装置A中发生反应的化学方程式是_____。
(3)装置B中盛放的是饱和NaCl溶液,作用是_____。
(4)装置F中试剂的作用是_____。
(5)装置G用于吸收多余Cl2,反应的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数的描述中正确的是( )
A. 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B. 相同温度下,反应A+BC与反应CA+B的化学平衡常数相同
C. 反应2SO2(g)+O2(g)2SO3(g) ΔH<0的化学平衡常数随温度升高而增大
D. 反应A(g)+B(g)2C(g)的平衡常数表达式为K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作、现象所得出的结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向氯水中滴加硝酸酸化的AgNO3溶液 | 产生白色沉淀 | 氯水中含有Cl﹣ |
B | 向某溶液中滴加盐酸 | 有无色气体产生 | 溶液中一定有CO32﹣ |
C | 向某溶液中加入烧碱溶液后加热,用湿润的红色石蕊试纸检验 | 石蕊试纸变蓝 | 溶液中有NH4+ |
D | 将SO2通入到酸性KMnO4溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
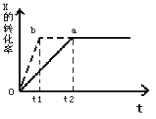
A. 降低温度B. 增大Y的浓度
C. 加入催化剂D. 增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动
C. 平衡向逆反应方向移动
D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业废气和汽车尾气中含有多种氮氧化物,氮氧化物能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。
(1)处理 NO 尾气通常是将 NO 与 O2 混合通入碱液中吸收。已知一定条件下有下列反应:
Ⅰ:2N2O5(g) ![]() 4NO2(g)+O2(g) △H1
4NO2(g)+O2(g) △H1
Ⅱ:2NO2(g)![]() 2NO(g)+O2(g) △H2
2NO(g)+O2(g) △H2
Ⅲ:2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) △H3
写出 NO 和O2 的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式______。
(2)常温下,NO 极易被 O2 氧化为 NO2,温度高于 423K 时,NO2 发生分解:2NO2(g) ![]() 2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
υ正=υ(NO2)消耗=k 正C2(NO2), υ逆=υ(NO)消耗=2υ(O2) 消耗=k 逆c2(NO)·c( O2),k 正、k 逆 为速率常数,受温度影响。不同温度下,将 NO2 置于体积为 VL 的密闭容器中,NO2 的物质的量的浓度与反应时间的关系如图所示:
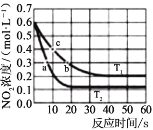
①T1 温度下 0-10s 内,O2 的反应速率υ(O2)=______、平衡常数 KT1=___________。
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采取的单一措施有______
③平衡常数KT1 ______ KT2 填“大于”“小于”或“等于”,下同);反应速率υa_______υb。
④计算 c 处υ正/υ逆=______。
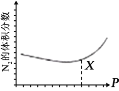
(3)NO 也 可 通 过 如 下 反 应 处 理 :6NO(g)+4NH3(g) =5N2(g) +6H2O(g);一定条件下,平衡时 N2 的体积分数与压强的关系如图所示。N2 的体积分数先减小后增大的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。图是硫元素的常见化合价与部分物质类别的对应关系。
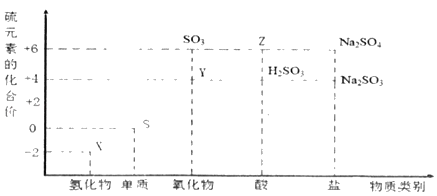
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的氧化物为_____(填化学式)。
(2)将X与Y混合可生成淡黄色固体,该反应的化学方程式为_____。
(3)Z的浓溶液与碳在一定条件下可以发生反应,体现了Z的_____性。
(4)写出硫与浓硫酸在加热条件下反应的化学方程式_____。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方法理论上可行的是_____(填字母)。
a.Na2SO3+S b.Na2S+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com