
����Ŀ��ij��ѧ��ȤС��������ϵ�֪����Ӧ�¶Ȳ�ͬ��������ԭ����ͭ�IJ���Ͳ�ͬ��������Cu��Cu2O��Cu��Cu2O��Ϊ������ˮ�ĺ�ɫ���壬��Cu2O����ϡ���ᷢ����Ӧ��Cu2O+H2SO4=CuSO4+Cu+H2O��Ϊ̽����Ӧ��ĺ�ɫ����ijɷ֣�������������¼��裺
����һ����ɫ����ֻ��Cu
���������ɫ����ֻ��Cu2O
����������ɫ��������Cu��Cu2O
�����ж���ȷ����
A.ȡ������ɫ���壬����������ϡ���ᣬ����Һ���������������һ�Ͷ�������
B.������ɫ����������ϡ���ᷴӦ������Һ����ɫ�����к�ɫ���壬��ֻ�м���������
C.����7.2�˺�ɫ����ͨ��������H2��ԭ�����õ�����6.4�ˣ�����������
D.ʵ���ҿ���������Cu(OH)2����Һ(����)�м��������Ǻ���ȣ�����ȡCu2O
���𰸡�CD
��������
A. ȡ������ɫ���壬����������ϡ���ᣬ����Һ����������˵����ɫ�����в���������ͭ��
B. ��������Һ�����ɫ��˵����ɫ�����к���������ͭ�����к�ɫ���壬˵����Ӧ���к�ɫ����ͭ���ڣ��ݴ˷�����
C. ���ݼ��������ɫ����ֻ��Cu2O���ͭ�غ���������֤��
D. ʵ���ҿ����������Ǻ����Ƶĺ�NaOH��Cu(OH)2����Һ�����Ⱥ���ȡCu2O��
A. ȡ������ɫ���壬����������ϡ���ᣬ����Һ����������˵����ɫ�����в���������ͭ�������һ�����������������������A����
B. ��������Һ�����ɫ��˵����ɫ�����к���������ͭ�����к�ɫ���壬˵����Ӧ���к�ɫ����ͭ���ڣ�������˵��ԭ��ɫ�����к���ͭ����Ϊ������ͭ��ϡ���ᷴӦҲ������ͭ������������������B����
C. ���������ɫ����ֻ��Cu2O����7.2 g Cu2O�����ʵ���n(Cu2O)=![]() =0.05 mol����H2��Ӧ������ͭ�����ʵ���Ϊ0.1 mol������Ϊ6.4 g�����Լ����������C��ȷ��
=0.05 mol����H2��Ӧ������ͭ�����ʵ���Ϊ0.1 mol������Ϊ6.4 g�����Լ����������C��ȷ��
D. �����Ǻ���ȩ�������������Ƶĺ�NaOH��Cu(OH)2����Һ�����Ⱥ���ȡCu2O��D��ȷ��
�ʺ���ѡ����CD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����̼����ﴦ����Cu2+��ˮ��ý���ͭ����������м�ͻ���̿����������ʱ����÷�ˮ��Cu2+Ũ���ڲ�ͬ��̼������(x)��������ʱ��仯����������ͼ��ʾ��

������������������
A. ����̿��Cu2+����һ������������
B. ��м�ͻ���̿������Һ���γ���أ���Ϊ����
C. ������̼���������̼��(x)��һ������߷�ˮ��Cu2+��ȥ������
D. ������̼�������պ�Cu2+��ˮ��ͭ�ķ�Ӧԭ����Fe+Cu2+��Fe2++Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����Ǹ��л�ѧ����ĺ��ģ�
��1����ͬ���ʵ�����NH3��H2S��������___�����Ӹ�����Ϊ___��ͬ��ͬѹ�µ������__��������ԭ�ӵĸ�����Ϊ____��
��2������m gij���壬����һ����������ԭ�ӹ��ɣ�����Ħ������ΪM g/mol���谢��٤������ΪNA����
�ٸ���������ʵ���Ϊ____mol��
�ڸ�������������ԭ������Ϊ____����
�۸������ڱ�״���µ����Ϊ___L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼ��仯���������������ж�����Ҫ��Ӧ�á�
(1)��֪HClO��ɱ��������ClO-ǿ��25��ʱ����������ˮ�γ���������ˮ��ϵ������ϵ��Cl2��HClO��ClO-�����ʵ���������a����pH�仯�Ĺ�ϵ��ͼ��ʾ����ͼ������Ҫʹ��ˮ��ɱ��Ч����ã�Ӧ������Һ��pH��Χ��_____________����pH=7.5ʱ����ˮ�к���Ԫ�ص�����_____________________��
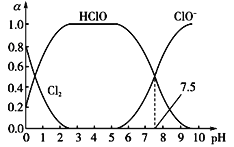
(2)��ҵ����������ʯ��������Ư�۵Ļ�ѧ����ʽΪ_______________________��
(3)��������(ClO2)�ǹ����Ϲ��ϵĸ�Ч����ȫ��ɱ������������ҵ���Ʊ�ClO2�ķ�ӦΪ2KClO3 + H2C2O4 + H2SO4 = K2SO4 + 2ClO2��+ 2X + 2H2O��
��X�Ļ�ѧʽΪ______________��
��ClO2��Cl2���������г��õ���������ClO2������Ч����Cl2��_______��������Ч�������ʵ�λ���ʵ����õ��ĵ�������ʾ����ԭ�����ΪCl-����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2(g)��H2(g)��һ�������·�Ӧ����NH3(g)����������ͼ������˵����ȷ����
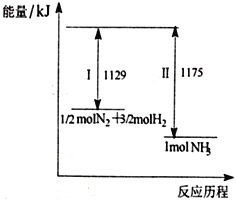
A. IΪ���ȹ��̡���Ϊ���ȹ���
B. 1/2 molN2��3/2molH2�ļ���֮�ʹ���1 mol NH3�ļ���
C. 1/2molN2��3/2molH2�����е�����֮�͵���1 mol NH3�����е�����
D. �ù��̵��Ȼ�ѧ��Ӧ����ʽΪN2(g)+3H2(g)![]() 2NH3(g) ��H=-92 kJ/mol
2NH3(g) ��H=-92 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȱ�������������������Ӧ���ɵ�һ�����dz��õ�����ˮ��������������Ҫ����һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)��
(1)�Ȱ�������ˮ����������Ϊˮ�����ɾ���ǿ��ɱ�����õ����ʣ������ʵĽṹʽΪ________�����Ȱ���ˮ��Ӧ�Ļ�ѧ����ʽΪ_____________����0.01 mol NCl3ͨ��100 mL 0.5 mol/L Na2SO3��Һ�У�ת�Ƶ��ӵ����ʵ���Ϊ_______mol��
(2)��֪���ֻ�ѧ���ļ��ܺͻ�ѧ��Ӧ�������仯���±�����ͼ��ʾ��
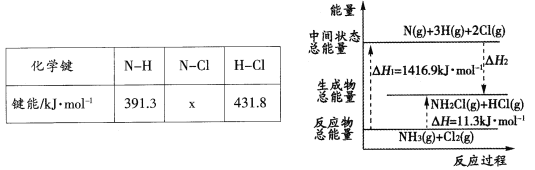
��Ӧ�����е���H2=____kJ��mol-1�����е�x=_____��
(3)���ܱ������з�ӦNH3(g)+Cl2(g)![]() NH2Cl(g)+HCl(g)�ﵽƽ�⣬ͨ������ѧ���ɼ��㣬��ͬ�¶���������NH2Cl�����������
NH2Cl(g)+HCl(g)�ﵽƽ�⣬ͨ������ѧ���ɼ��㣬��ͬ�¶���������NH2Cl�����������![]() �ı仯����ͼ��ʾ��
�ı仯����ͼ��ʾ��
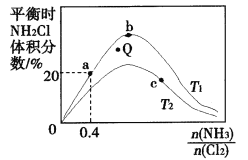
��a��b��c�����Ӧƽ�ⳣ���Ĵ�С��ϵ��(�ֱ���Ka��Kb��Kc��ʾ)_________��b��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ________��
��T2�棬Q���Ӧ�����ʣ�![]() __________
__________![]() (����>������<������=��)��
(����>������<������=��)��
���ڰ��ȱ�һ��ʱ�����NH3��ת���ʵķ�����__________(��д1��)��
�������ﶼ�����壬ʵ����NH2C1���������ʼ�ձ�����ֵ�ͣ�ԭ�������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��һ��������2SO2(g)��O2(g)![]() 2SO3(g) ��H����QkJ��mol��1����һ�ܱ������м���2molSO2��1molO2����ƽ��ʱSO2��ת����Ϊ90%���ų�������ΪQ1������һ��ͬ�����м���2molSO3������ͬ�����£���ƽ��ʱ���յ�����ΪQ2�������й�ϵ����ȷ���ǣ� ��
2SO3(g) ��H����QkJ��mol��1����һ�ܱ������м���2molSO2��1molO2����ƽ��ʱSO2��ת����Ϊ90%���ų�������ΪQ1������һ��ͬ�����м���2molSO3������ͬ�����£���ƽ��ʱ���յ�����ΪQ2�������й�ϵ����ȷ���ǣ� ��
A. Q>Q1>Q2B. Q2>Q>Q1C. Q1>Q>Q2D. Q>Q1��Q2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B�������д̼���ζ�����塣�Ը�������ʵ����ʵ��ա�
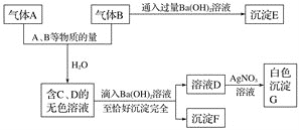
(1)д��A��F�����ʵĻ�ѧʽ��
A__________��B__________��C__________��D__________��E__________��F__________��
(2)д��A��B��ˮ��Ӧ�����ӷ���ʽ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�������ɳ����ԭ�����͵��ǣ� ��
A. Fe(SCN)3��Һ�м������KSCN����ɫ����
B. �غ�ɫNO2��ѹ����ɫ�ȱ�����dz
C. SO2��������SO3�ķ�Ӧ��������Ҫʹ�ô���
D. ��ѹ�ȳ�ѹ������NH3�ĺϳ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com