
����Ŀ���ȼ��仯���������������ж�����Ҫ��Ӧ�á�
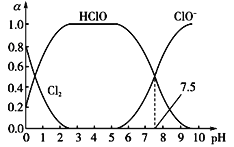
(1)��֪HClO��ɱ��������ClO-ǿ��25��ʱ����������ˮ�γ���������ˮ��ϵ������ϵ��Cl2��HClO��ClO-�����ʵ���������a����pH�仯�Ĺ�ϵ��ͼ��ʾ����ͼ������Ҫʹ��ˮ��ɱ��Ч����ã�Ӧ������Һ��pH��Χ��_____________����pH=7.5ʱ����ˮ�к���Ԫ�ص�����_____________________��
(2)��ҵ����������ʯ��������Ư�۵Ļ�ѧ����ʽΪ_______________________��
(3)��������(ClO2)�ǹ����Ϲ��ϵĸ�Ч����ȫ��ɱ������������ҵ���Ʊ�ClO2�ķ�ӦΪ2KClO3 + H2C2O4 + H2SO4 = K2SO4 + 2ClO2��+ 2X + 2H2O��
��X�Ļ�ѧʽΪ______________��
��ClO2��Cl2���������г��õ���������ClO2������Ч����Cl2��_______��������Ч�������ʵ�λ���ʵ����õ��ĵ�������ʾ����ԭ�����ΪCl-����
���𰸡�2 < pH < 6 HClO��ClO-��Cl- 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O CO2 2.5
��������
(1)HClO��ɱ��������ClO��ǿ����HClO����Խ����ɱ��Ч��Խ�ã�����ϵ�д��ڵ�ƽ����������ˮ��Ӧƽ�⡢������ĵ���ƽ�⡢�������ܽ�ƽ�⣻
(2)��������ʯ���鷴Ӧ�����Ȼ��ơ�������ƺ�ˮ��
(3)�ٹ�ҵ���Ʊ�ClO2�ķ�Ӧԭ��Ϊ��2KCIO3+H2C2 O4+H2SO4��K2SO4+2ClO2+2X+2H2O��ԭ���غ�õ�X�Ļ�ѧʽ��
��ÿĦ��Cl2�õ�2mol���ӣ���ÿĦ��ClO2�õ�5mol���ӣ����ݵ����غ������
(1)HClO��ɱ��������ClO��ǿ����HClO����Խ����ɱ��Ч��Խ�ã�����ͼ֪��pH��2��6ʱHClO�����ϸߣ�����2 < pH < 6 ʱƯ��Ч���Ϻã����ȵ����ʴ���ƽ���״̬Ϊ������ˮ��Ӧ�����������ƽ�⣬Һ̬��������̬������ƽ��ȣ���������ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ���ֱ���ƽ�ⷽ��ʽ��ʾΪCl2(aq)+H2OHClO+H++Cl����HClOH++ClO����Cl2(g)Cl2(aq)����pH��7.5ʱ����ˮ�к���Ԫ�ص����У�HClO��ClO����Cl����
(2)��ҵ����������ʯ���鷴Ӧ����Ư�۵Ļ�ѧ����ʽΪ��2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O��
(3)�ٹ�ҵ���Ʊ�ClO2�ķ�Ӧԭ��Ϊ��2KCIO3+H2C2 O4+H2SO4��K2SO4+2ClO2+2X+2H2O��ԭ���غ�õ�XΪCO2��
��ClO2��Cl2�Ļ�ԭ���ﶼΪCl����ÿĦ��Cl2�õ�2mol���ӣ���ÿĦ��ClO2�õ�5mol���ӣ�������Cl2�����ʵ�����ClO2��2.5����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о�������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���塣
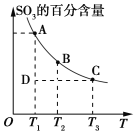
��1����������������2SO2(g)��O2(g)![]() 2SO3(g)��ƽ������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ��ͼ��ʾ��������ͼ�ش����⣺
2SO3(g)��ƽ������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ��ͼ��ʾ��������ͼ�ش����⣺
2SO2(g)��O2(g)![]() 2SO3(g)�Ħ�H___0(�>����<��)��
2SO3(g)�Ħ�H___0(�>����<��)��
��2��һ�������£��ϳɰ���ӦΪ��N2(g)��3H2(g)![]() 2NH3(g)��ͼ1��ʾ�ڴ˷�Ӧ�����е������仯��ͼ2��ʾ��2L���ܱ������з�ӦʱN2�����ʵ�����ʱ��ı仯���ߡ�ͼ3��ʾ�������������������£��ı���ʼ�����������ʵ����Դ˷�Ӧƽ���Ӱ�졣
2NH3(g)��ͼ1��ʾ�ڴ˷�Ӧ�����е������仯��ͼ2��ʾ��2L���ܱ������з�ӦʱN2�����ʵ�����ʱ��ı仯���ߡ�ͼ3��ʾ�������������������£��ı���ʼ�����������ʵ����Դ˷�Ӧƽ���Ӱ�졣
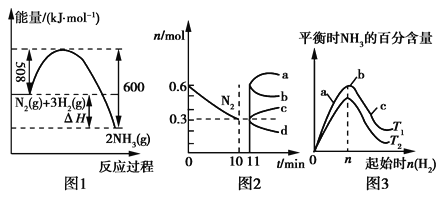
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ____�������¶ȣ�ƽ�ⳣ��____(�������С�����䡱)��
����ͼ2��Ϣ������0��10min�ڸ÷�Ӧ��ƽ������v(H2)____����11 min�������������䣬ѹ�����������Ϊ1 L����n(N2)�ı仯����Ϊ___(�a����b����c����d��)��
��ͼ3��a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ���___�㣬�¶�T1____T2(�>����������<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ���淴Ӧ2A(g)+B(g) ![]() 2C(g)(����ӦΪ���ȷ�Ӧ)����ȷͼ��Ϊ
2C(g)(����ӦΪ���ȷ�Ӧ)����ȷͼ��Ϊ
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������100mL0.5 mol��L-1Na2CO3��Һ�������й�˵����ȷ���ǣ� ��
A.ʵ�������Ƹ���Һ������ʱ���ӿ��ߣ���������ҺŨ��ƫ��
B.����Һϡ��10����c(Na��)��0.05 mol��L-1
C.�Ӹ���Һ��ȡ��10mL����ȡ��Һ�����ʵ����ʵ���Ũ��Ϊ0.05 mol��L-1
D.����Һ�к���Na2CO3������Ϊ5.3g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��C�����ʯ��s��+O2��g��=CO2��g�� ��H1 ��
C��ʯī��s��+O2��g��=CO2��g�� ��H2��
C��ʯī��s��=C�����ʯ��s����H3=+1.9kJ/mol ����˵����ȷ����
A. ���ʯ��ʯī�ȶ� B. ��H1 > ��H2
C. ��H3=��H1 ����H2 D. ʯīת���ɽ��ʯ�ķ�Ӧ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(C1O2)��������ˮ�Ҳ���ˮ��Ӧ�Ļ���ɫ���壬�е�Ϊ11�档ijС����ʵ�������Ʊ�C1O2��װ�����£�[��֪��SO2+2NaC1O3+H2SO4=2C1O2+2NaHSO4]
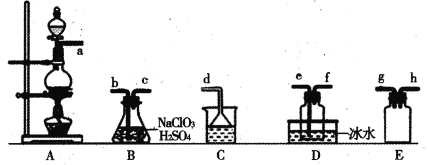
����˵����ȷ����
A.����װ��ʱ�����ܿ�aӦ��h��g�����ܿ�cӦ��e
B.װ��C��װ���DZ���ʳ��ˮ�����ܿ�aͨ��������ΪSO2
C.װ��D�ű�ˮ��Ŀ����Һ��SO2����ֹ��Ⱦ����
D.��ѡ��װ��A����1 mol��L-1������MnO2��Ӧ��ȡCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��������ϵ�֪����Ӧ�¶Ȳ�ͬ��������ԭ����ͭ�IJ���Ͳ�ͬ��������Cu��Cu2O��Cu��Cu2O��Ϊ������ˮ�ĺ�ɫ���壬��Cu2O����ϡ���ᷢ����Ӧ��Cu2O+H2SO4=CuSO4+Cu+H2O��Ϊ̽����Ӧ��ĺ�ɫ����ijɷ֣�������������¼��裺
����һ����ɫ����ֻ��Cu
���������ɫ����ֻ��Cu2O
����������ɫ��������Cu��Cu2O
�����ж���ȷ����
A.ȡ������ɫ���壬����������ϡ���ᣬ����Һ���������������һ�Ͷ�������
B.������ɫ����������ϡ���ᷴӦ������Һ����ɫ�����к�ɫ���壬��ֻ�м���������
C.����7.2�˺�ɫ����ͨ��������H2��ԭ�����õ�����6.4�ˣ�����������
D.ʵ���ҿ���������Cu(OH)2����Һ(����)�м��������Ǻ���ȣ�����ȡCu2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Fe2O3��SiO2�ȣ�Ϊԭ���Ʊ����ƣ�FeOOH����һ�ֹ����������£�
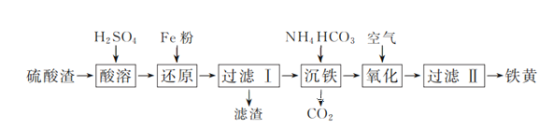
��1�����������мӿ��ܽ�ķ���Ϊ____��д��һ�֣���
��2������ԭ�������е����ӷ���ʽΪ_______��
��3����������������������Fe��OH��2�Ļ�ѧ����ʽΪ_______��������CaCO3����������������FeCO3����������Ӧ���ʱ����Һ��c��Ca2����/c��Fe2����=________��[��֪Ksp��CaCO3��=2.8��10��9��Ksp��FeCO3��=2��10��11]
��4����������ʱ����NaNO2Ũ��Һ�����������Fe��OH��2��Һ������������ʱ�䣬��ȱ����_________��
��5����̿��ԭ�����������ܳ����������Դ����1225�桢n��C��/n��O��=1.2ʱ������ʱ����������ʵĹ�ϵ��ͼ��ʱ�䳬��15min���������½���ԭ����_______��
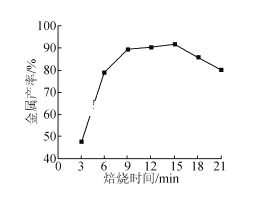
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧƽ�ⳣ������������ȷ���ǣ� ��
A. ��ѧƽ�ⳣ���Ĵ�Сȡ���ڻ�ѧ��Ӧ���������������������
B. ��ͬ�¶��£���ӦA��BC�뷴ӦCA��B�Ļ�ѧƽ�ⳣ����ͬ
C. ��Ӧ2SO2(g)��O2(g)2SO3(g) ��H<0�Ļ�ѧƽ�ⳣ�����¶����߶�����
D. ��ӦA(g)��B(g)2C(g)��ƽ�ⳣ������ʽΪK��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com