
【题目】用来表示可逆反应2A(g)+B(g) ![]() 2C(g)(正反应为放热反应)的正确图像为
2C(g)(正反应为放热反应)的正确图像为
A.  B.
B. 
C.  D.
D. 
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
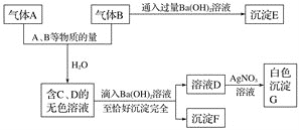
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。

下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是有机化学重要的中间体,能用于合成药物和农药,其合成路线如图:
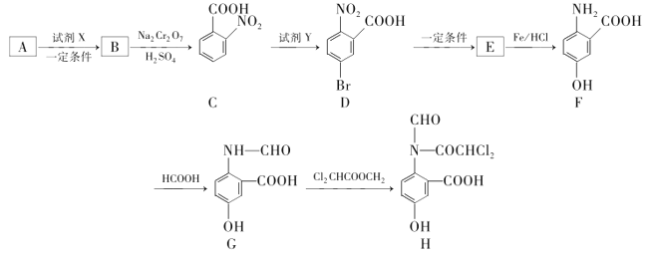
(1)E的结构简式是___;可以测量G的相对分子质量的仪器为___。
(2)B中含氧官能团的名称是__。
(3)A的分子式为C7H8,A生成B的化学反应方程式为___,反应类型是___。
(4)试剂Y是___。
(5)写出同时满足下列条件的F的一种同分异构体的结构简式:____。
①能发生水解反应,能与FeCl3溶液发生显色反应
②能发生银镜反应
③分子中有5种不同化学环境的氢原子
(6)根据题干信息,以苯为原料(无机试剂任选),画出制备防弹材料![]() 的流程示意图___。
的流程示意图___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题。
(Ⅰ)下列一组有水参与的反应
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
⑤2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是_____________(填编号)。
(2)在这些氧化还原反应中,水既作氧化剂,又作还原剂是___________(填编号),水既不作氧化剂,又不作还原剂是__________(填编号)。
(3)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?___________(填“是”或“不是”),若是,这个反应的氧化剂和还原剂的质量比是________;
(Ⅱ)写出下列反应的离子方程式
①铜片与稀硝酸的反应_____________________________________;
②往氯化铝溶液中加入过量的NaOH溶液______________________;
(Ⅲ)写出下列反应的化学方程式
①二氧化硫发生催化氧化反应_________________________________;
②制漂白液的反应____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO33H2O2)又名过氧碳酸钠,白色颗粒状粉末,其水溶液呈碱性,50℃可分解为碳酸钠和过氧化氢,具有Na2CO3和H2O2的双重性质,是很好的消毒剂、漂白剂、供氧剂。以工业碳酸钠和H2O2为原料制备过碳酸钠的实验装置及步骤:
I.称取10.0g碳酸钠,溶于40mL蒸馏水中,冷却至273K待用。
II.量取15mL30%的H2O2溶液加入到三颈烧瓶中,冷却至273K后,加入复合稳定剂,搅拌均匀。
III.在控温及搅拌条件下,将碳酸钠溶液滴入到步骤II的混合液中,待反应液冷却至268K左右,边搅拌边加入4.0gNaCl,静置结晶。
IV.过滤,用无水乙醇洗涤后,真空干燥。
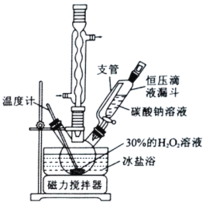
请回答以下问题:
(1)球形冷凝管中回流的主要物质除H2O外还有__________________(填化学式)。
(2)制备过程中涉及的反应及干燥等操作均需在较低温度下进行,原因是________________。
(3)步骤II中加入复合稳定剂的目的之一是与工业碳酸钠中含有的Fe3+生成稳定的配合物,以防Fe3+对制备反应产生不良影响。该不良影响是指__________________________。
(4)步骤IV中完成"过滤”操作所需玻璃仪器有烧杯、____________和____________.
(5)产品中H2O2含量的测定
准确称取产品0.1000g于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2mol·L-1H3PO4溶液,再加入lgKI固体(过量),摇匀后于暗处放置10min,加入适量指示剂,用0.1000rnol·L-1Na2S2O3标准液滴定至终点,消耗Na2S2O3标准溶液17.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①所加指示剂的名称是____________;确定达到滴定终点的依据是_____________
②若加入KI固体摇匀后未将碘量瓶“在暗处放置10min”,就立即进行滴定操作,测定的结果将会____________(选填“偏大"、“偏小”或“无影响”)。
③根据实验数据计算产品中H2O2的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学计算的核心:
(1)相同物质的量的NH3和H2S的质量比___,分子个数比为___,同温同压下的体积比__,所含氢原子的个数比为____.
(2)现有m g某气体,它的一个分子由四原子构成,它的摩尔质量为M g/mol.设阿伏伽德罗常数为NA,则:
①该气体的物质的量为____mol.
②该气体中所含的原子总数为____个.
③该气体在标准状况下的体积为___L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生产生活中都有重要的应用。
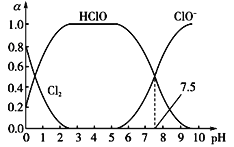
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。由图分析,要使氯水的杀菌效果最好,应控制溶液的pH范围是_____________,当pH=7.5时,氯水中含氯元素的微粒有_____________________。
(2)工业上用氯气与石灰乳生产漂白粉的化学方程式为_______________________。
(3)二氧化氯(ClO2)是国际上公认的高效、安全的杀菌消毒剂。工业上制备ClO2的反应为2KClO3 + H2C2O4 + H2SO4 = K2SO4 + 2ClO2↑+ 2X + 2H2O。
①X的化学式为______________。
②ClO2和Cl2均是生活中常用的消毒剂,ClO2的消毒效率是Cl2的_______倍(消毒效率以物质单位物质的量得到的电子数表示,还原产物均为Cl-。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。

(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com