
【题目】H是有机化学重要的中间体,能用于合成药物和农药,其合成路线如图:
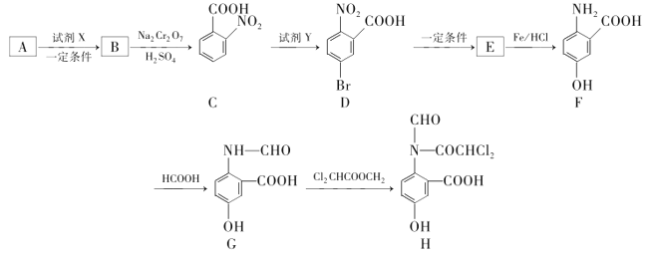
(1)E的结构简式是___;可以测量G的相对分子质量的仪器为___。
(2)B中含氧官能团的名称是__。
(3)A的分子式为C7H8,A生成B的化学反应方程式为___,反应类型是___。
(4)试剂Y是___。
(5)写出同时满足下列条件的F的一种同分异构体的结构简式:____。
①能发生水解反应,能与FeCl3溶液发生显色反应
②能发生银镜反应
③分子中有5种不同化学环境的氢原子
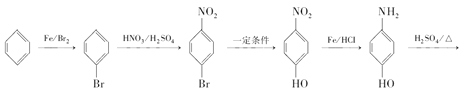
(6)根据题干信息,以苯为原料(无机试剂任选),画出制备防弹材料![]() 的流程示意图___。
的流程示意图___。
【答案】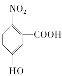 质谱仪 硝基
质谱仪 硝基 ![]() +HNO3
+HNO3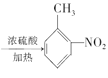 +H2O 取代反应 Br2/Fe
+H2O 取代反应 Br2/Fe 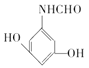 或
或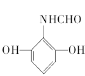
![]()
【解析】
A的分子式为C7H8,根据C的结构简式可逆推得A为![]() ,A发生硝化反应生成B为
,A发生硝化反应生成B为 ,B发生氧化反应生成C,C在铁粉作催化剂的条件下与溴发生取代反应生成D(
,B发生氧化反应生成C,C在铁粉作催化剂的条件下与溴发生取代反应生成D( ),根据E生成F的条件可知,E中的硝基被还原生成F中的氨基,则D发生取代反应生成E,E为
),根据E生成F的条件可知,E中的硝基被还原生成F中的氨基,则D发生取代反应生成E,E为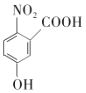 ,E发生还原反应生成F,F发生取代反应生成G,G再发生取代反应生成H,据此分析解答。
,E发生还原反应生成F,F发生取代反应生成G,G再发生取代反应生成H,据此分析解答。
(1)根据上面的分析可知,E的结构简式是  ;可以测量G的相对分子质量的仪器为质谱仪,故答案为:
;可以测量G的相对分子质量的仪器为质谱仪,故答案为: ;质谱仪;
;质谱仪;
(2)B为 ,B中含氧官能团为硝基,故答案为:硝基:
,B中含氧官能团为硝基,故答案为:硝基:
(3)A发生硝化反应生成B,A生成B的化学方程式为 ![]() +HNO3
+HNO3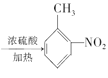 +H2O,反应类型是取代反应,故答案为:
+H2O,反应类型是取代反应,故答案为:![]() +HNO3
+HNO3 +H2O;取代反应(或硝化反应);
+H2O;取代反应(或硝化反应);
(4)C在铁粉作催化剂的条件下与溴发生取代反应生成D,所以试剂Y是Br2/Fe,故答案为:Br2/Fe(或Br2/FeBr3);
(5)F为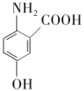 ,①能发生水解反应,能与FeCl3溶液发生显色反应,说明结构中有肽键和酚羟基,②能发生银镜反应,说明有醛基,③分子中有5种不同化学环境的氢原子,同时满足条件的F的同分异构体的结构简式为:
,①能发生水解反应,能与FeCl3溶液发生显色反应,说明结构中有肽键和酚羟基,②能发生银镜反应,说明有醛基,③分子中有5种不同化学环境的氢原子,同时满足条件的F的同分异构体的结构简式为: 或
或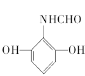 ,故答案为:
,故答案为: 或
或 或;
或;
(6)以苯为原料制备防弹材料![]() ,首先用苯与溴发生取代生成溴苯,再用溴苯发生硝化反应生成对溴硝基苯,对溴硝基苯中溴原子发生取代生成对硝基苯酚,对硝基苯酚还原为对氨基苯酚,用对氨基苯酚发生缩聚反应可生成
,首先用苯与溴发生取代生成溴苯,再用溴苯发生硝化反应生成对溴硝基苯,对溴硝基苯中溴原子发生取代生成对硝基苯酚,对硝基苯酚还原为对氨基苯酚,用对氨基苯酚发生缩聚反应可生成![]() ,合成路线为
,合成路线为
![]() ,故答案为:
,故答案为:
![]() 。
。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
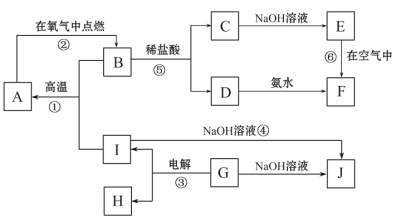
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)写出下列物质的化学式A_______________;G____________________;
(2)若C→D为化合反应,则此时的化学方程式_______________________________;
(3)写出E→F的化学方程式___________________________________________ ;
(4)写出反应④的离子方程式___________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
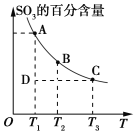
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据如图回答问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据如图回答问题:
2SO2(g)+O2(g)![]() 2SO3(g)的ΔH___0(填“>”或“<”)。
2SO3(g)的ΔH___0(填“>”或“<”)。
(2)一定条件下,合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)。图1表示在此反应过程中的能量变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
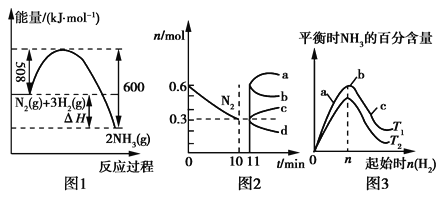
①该反应的平衡常数表达式为____,升高温度,平衡常数____(填“增大”“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)____,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为___(填“a”“b”“c”或“d”)。
③图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是___点,温度T1____T2(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量X气体通入Y溶液中,实验结果与预测的现象一致的组合是
X气体 | Y溶液 | 预测的现象 |
| |
① | CO2 | 饱和Na2CO3溶液 | 白色沉淀析出 | |
② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
③ | Cl2 | AgNO3溶液 | 白色沉淀析出 | |
④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
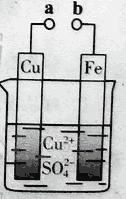
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(ZnS)=l.6×10-24,Ksp(FeS)=6.4×10-18,其中FeS为黑色晶体,ZnS是一种白色颜料的组成成分。下列说法正确的是
A.向物质的量浓度相等的FeSO4和ZnSO4混合液中滴加Na2S溶液,先产生黑色沉淀
B.常温下,反应FeS(s)+Zn2+(aq)ZnS(s)+Fe2+(aq)的平衡常数K=4.0×l06
C.在ZnS的饱和溶液中,加入FeSO4溶液,一定不会产生FeS沉淀
D.向FeS悬浊液中通入少许HC1,c(Fe2+)与Ksp(FeS)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于100mL0.5 mol·L-1Na2CO3溶液,下列有关说法正确的是( )
A.实验室配制该溶液,定容时仰视刻线,所配制溶液浓度偏大
B.该溶液稀释10倍后,c(Na+)=0.05 mol·L-1
C.从该溶液中取出10mL,所取溶液中溶质的物质的量浓度为0.05 mol·L-1
D.该溶液中含有Na2CO3的质量为5.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
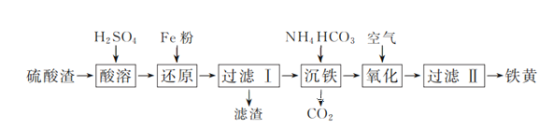
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
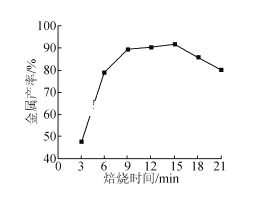
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com