
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
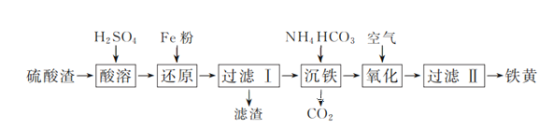
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
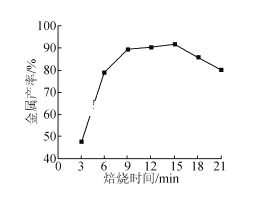
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
【答案】加热或搅拌或适当增大硫酸浓度(写一种) Fe+2Fe3+=3Fe2+ FeSO4+2NH4HCO3=Fe(OH)2↓+(NH4)2SO4+2CO2↑ 140 NaNO2被还原为氮氧化物,污染空气 还原剂消耗完,空气进入使铁再次氧化
【解析】
(1)硫酸渣中Fe2O3溶于硫酸生成硫酸铁溶液,SiO2不溶于硫酸,加入过量铁粉,硫酸铁被还原为硫酸亚铁,滤液中加入碳酸氢铵,生成Fe(OH)2沉淀和二氧化碳,通入氧气Fe(OH)2被氧化为FeOOH。
(1)加热、搅拌或适当增大硫酸浓度可加快“酸溶”中溶解速率。
(2)“还原”过程中硫酸铁被铁粉还原为硫酸亚铁,反应的离子方程式为Fe+2Fe3+=3Fe2+。
(3)①“沉铁”过程中硫酸亚铁、碳酸氢铵反应生成Fe(OH)2、二氧化碳、硫酸铵,反应的化学方程式为FeSO4+2NH4HCO3= Fe(OH)2↓+(NH4)2SO4+2CO2↑。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液为碳酸钙、碳酸亚铁的饱和溶液,溶液中![]() ;
;
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,NaNO2被还原为氮氧化物,污染空气。
(5)焦炭还原硫酸渣炼铁,在1225℃、n(C)/n(O)=1.2时,焙烧时间超过15min,还原剂消耗完,空气进入使铁再次氧化,所以金属产率下降。


科目:高中化学 来源: 题型:
【题目】H是有机化学重要的中间体,能用于合成药物和农药,其合成路线如图:
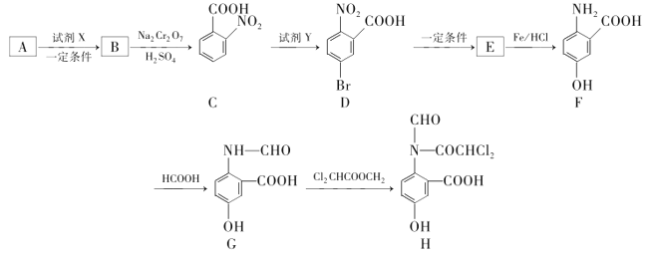
(1)E的结构简式是___;可以测量G的相对分子质量的仪器为___。
(2)B中含氧官能团的名称是__。
(3)A的分子式为C7H8,A生成B的化学反应方程式为___,反应类型是___。
(4)试剂Y是___。
(5)写出同时满足下列条件的F的一种同分异构体的结构简式:____。
①能发生水解反应,能与FeCl3溶液发生显色反应
②能发生银镜反应
③分子中有5种不同化学环境的氢原子
(6)根据题干信息,以苯为原料(无机试剂任选),画出制备防弹材料![]() 的流程示意图___。
的流程示意图___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生产生活中都有重要的应用。
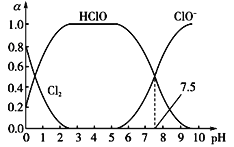
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。由图分析,要使氯水的杀菌效果最好,应控制溶液的pH范围是_____________,当pH=7.5时,氯水中含氯元素的微粒有_____________________。
(2)工业上用氯气与石灰乳生产漂白粉的化学方程式为_______________________。
(3)二氧化氯(ClO2)是国际上公认的高效、安全的杀菌消毒剂。工业上制备ClO2的反应为2KClO3 + H2C2O4 + H2SO4 = K2SO4 + 2ClO2↑+ 2X + 2H2O。
①X的化学式为______________。
②ClO2和Cl2均是生活中常用的消毒剂,ClO2的消毒效率是Cl2的_______倍(消毒效率以物质单位物质的量得到的电子数表示,还原产物均为Cl-。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质的结构式为________,二氯胺与水反应的化学方程式为_____________。将0.01 mol NCl3通入100 mL 0.5 mol/L Na2SO3溶液中,转移电子的物质的量为_______mol。
(2)已知部分化学键的键能和化学反应的能量变化如下表和下图所示。
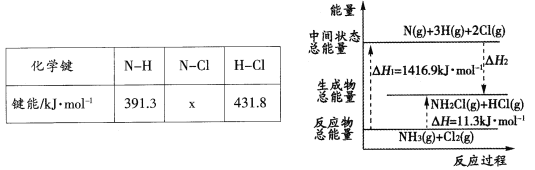
则反应过程中的△H2=____kJ·mol-1,表中的x=_____。
(3)在密闭容器中反应NH3(g)+Cl2(g)![]() NH2Cl(g)+HCl(g)达到平衡,通过热力学定律计算,不同温度下理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,通过热力学定律计算,不同温度下理论上NH2Cl的体积分数随![]() 的变化如下图所示。
的变化如下图所示。
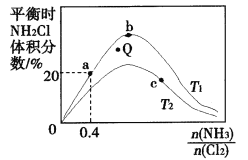
①a、b、c三点对应平衡常数的大小关系是(分别用Ka、Kb、Kc表示)_________。b点时,该反应的平衡常数为________;
②T2℃,Q点对应的速率:![]() __________
__________![]() (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
③在氨氯比一定时,提高NH3的转化率的方法是__________(任写1种);
④若产物都是气体,实验测得NH2C1的体积分数始终比理论值低,原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A. Q>Q1>Q2B. Q2>Q>Q1C. Q1>Q>Q2D. Q>Q1=Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
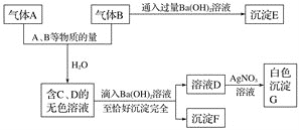
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。(已知反应:I2+2S2O32-=2I-+S4O62-)计算该水样中的溶解氧(以mg·L1表示),写出计算过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1)铜原子核外电子共有__种不同运动状态,基态铜原子的核外占据最高能层电子的电子云轮廓图形状为__。
(2)根据铜、锌原子结构可知第二电离能I2(Zn)__I2(Cu)填“大于”或“小于” 。
(3)向蓝色硫酸铜溶液[Cu(H2O)4]2+中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。
①H2O分子中心原子的杂化类型为__;分子中的键角:H2O__NH3(填“大于”或“小于”)。
②通过上述实验现象可知,与Cu2+的配位能力:H2O__NH3(填“大于”或“小于”)。
③氨硼烷(BH3—NH3)可以作为机动车使用的备选氢来源或氢储存的材料。
下列与氨硼烷是等电子体的有__(填编号)。
A.乙烷 B.H2O2 C.H3PO4 D.S8
④写出BH3—NH3的结构式 结构中若含配位键用→表示 __。
(4)某磷青铜晶胞结构如图所示。
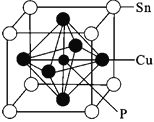
①其化学式为__。
②若晶体密度为8.82g/cm3,最近的Cu原子核间距为__cm(用NA表示阿伏加德罗常数,用M表示该晶体的摩尔质量)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com