
【题目】水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:__________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。(已知反应:I2+2S2O32-=2I-+S4O62-)计算该水样中的溶解氧(以mg·L1表示),写出计算过程__________。
【答案】O2+2Mn2++4OH-=2MnO(OH)2↓ 在100.00ml水样中发生反应:I2+2S2O32-=2I-+S4O62-,消耗0.01000mol/LNa2S2O3标准液13.50mL,则转化n(I2)=![]() 13.5010-30.01000mol=6.75010-5mol,MnO(OH)2与I完全反应生成Mn2+和I2,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.75010-5mol,再根据电子得失守恒:n(O2)=
13.5010-30.01000mol=6.75010-5mol,MnO(OH)2与I完全反应生成Mn2+和I2,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.75010-5mol,再根据电子得失守恒:n(O2)=![]() n[MnO(OH)2]=
n[MnO(OH)2]=![]() 6.75010-5mol=3.37510-5mol,该水样中的溶解氧=
6.75010-5mol=3.37510-5mol,该水样中的溶解氧=![]() =10.80 mg·L1
=10.80 mg·L1
【解析】
①氧气将Mn2+氧化为MnO(OH)2,由生成物可知该反应是在碱性条件下反应,结合电子、电荷及原子守恒书写离子方程式;
②根据方程式计算转化I2的量,据此计算水样中的溶解氧量。
①氧气将Mn2+氧化为MnO(OH)2的反应中,氧气是氧化剂,1molO2得到4mol电子,锰元素的化合价由+2价升高到+4价,失去2个电子,由电子、电荷、以及原子守恒可知该反应的离子方程式为:O2+2Mn2++4OH-=2MnO(OH)2↓;
②在100.00ml水样中发生反应:I2+2S2O32-=2I-+S4O62-,消耗0.01000mol/LNa2S2O3标准液13.50mL,则转化n(I2)=![]() 13.5010-30.01000mol=6.75010-5mol,MnO(OH)2与I完全反应生成Mn2+和I2,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.75010-5mol,再根据电子得失守恒:n(O2)=
13.5010-30.01000mol=6.75010-5mol,MnO(OH)2与I完全反应生成Mn2+和I2,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.75010-5mol,再根据电子得失守恒:n(O2)=![]() n[MnO(OH)2]=
n[MnO(OH)2]=![]() 6.75010-5mol=3.37510-5mol,该水样中的溶解氧=
6.75010-5mol=3.37510-5mol,该水样中的溶解氧=![]() =10.80 mg·L1。
=10.80 mg·L1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于100mL0.5 mol·L-1Na2CO3溶液,下列有关说法正确的是( )
A.实验室配制该溶液,定容时仰视刻线,所配制溶液浓度偏大
B.该溶液稀释10倍后,c(Na+)=0.05 mol·L-1
C.从该溶液中取出10mL,所取溶液中溶质的物质的量浓度为0.05 mol·L-1
D.该溶液中含有Na2CO3的质量为5.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
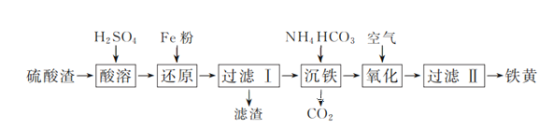
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
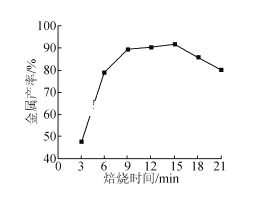
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A. 该固体中一定含有NH4+、CO32-、SO42-、Na+ B. 该固体中一定没有Cu2+、Cl-、Na+
C. 该固体中只含有NH4+、CO32-、SO42-、Cl- D. 根据以上实验,无法确定该固体中有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3(183℃升华)遇潮湿空气即变质,同时产生大量白雾,实验室可用下列装置制备。

(1)反应前,装置A中盛放浓盐酸的仪器名称是_____。
(2)反应时,装置A中发生反应的化学方程式是_____。
(3)装置B中盛放的是饱和NaCl溶液,作用是_____。
(4)装置F中试剂的作用是_____。
(5)装置G用于吸收多余Cl2,反应的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1L0.1mol/L的Na2CO3溶液中含阴离子总数为0.1NA
B.7.8gNa2O2与过量CO2反应时,转移的电子数为0.2NA
C.2gH218O与D216O的混合物中所含的中子数和电子数均为NA
D.足量乙烷与22.4L(标准状况)Cl2发生取代反应,形成C-Cl键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数的描述中正确的是( )
A. 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B. 相同温度下,反应A+BC与反应CA+B的化学平衡常数相同
C. 反应2SO2(g)+O2(g)2SO3(g) ΔH<0的化学平衡常数随温度升高而增大
D. 反应A(g)+B(g)2C(g)的平衡常数表达式为K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
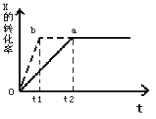
A. 降低温度B. 增大Y的浓度
C. 加入催化剂D. 增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,原子最外层电子数之和为17。其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
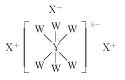
A.原子半径:Z>Y>X>W
B.X与Z形成的化合物会抑制水的电离
C.X、Z均能形成两种常见氧化物
D.W的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com