
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:
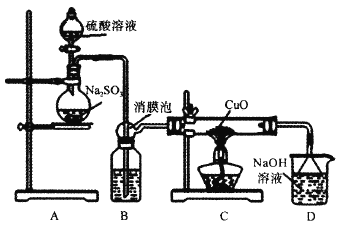
Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为___,消膜泡的作用是__。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为____(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值____(填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为___。
【答案】浓硫酸 防止B中液体被吹入装置C中 98%的H2SO4溶液中c(H+)较小,反应速率较小 3CuO+SO2![]() CuSO4+Cu2O 量筒
CuSO4+Cu2O 量筒 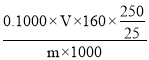 ×100% 偏小 SCN-+4I2+4H2O=SO42-+7I-+ICN+8H+
×100% 偏小 SCN-+4I2+4H2O=SO42-+7I-+ICN+8H+
【解析】
实验室一般用中等浓度的硫酸和亚硫酸盐反应制备SO2,所以装置A是制备SO2的装置,发生的反应为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,制备的SO2中含有水蒸气,应用浓硫酸干燥,消膜泡防止B中的浓硫酸被SO2的气流吹入C装置中,SO2进入C装置中与CuO发生氧化还原反应,其反应方程式为:3CuO+SO2![]() CuSO4+Cu2O,多余的SO2被NaOH溶液吸收,D装置是尾气处理装置。
CuSO4+Cu2O,多余的SO2被NaOH溶液吸收,D装置是尾气处理装置。
Ⅰ.(1)制备SO2时含有水蒸气杂质,应用浓硫酸干燥,所以装置B中放入浓硫酸,目的是除去水蒸气;消膜泡所起的主要作用是防止B中的浓硫酸被SO2的气流吹入C装置中,故答案为:浓硫酸;防止B中液体被吹入装置C中;
(2)制取SO2的反应实质是氢离子和亚硫酸根离子反应,98%的硫酸溶液中溶质主要是硫酸分子,而氢离子浓度较小,所以反应速率较慢,故答案为:98%的H2SO4溶液中c(H+)较小,反应速率较小;
(3)根据信息,可以得出产物有硫酸铜和氧化亚铜,其反应方程式为:3CuO+SO2![]() CuSO4+Cu2O,故答案为:3CuO+SO2
CuSO4+Cu2O,故答案为:3CuO+SO2![]() CuSO4+Cu2O;
CuSO4+Cu2O;
Ⅱ. (4)①标准溶液滴定前需要标定,不需要特别精准体积的容量瓶,所以配制Na2S2O3标准溶液时需要的玻璃仪器除了烧杯、玻璃棒和试剂瓶外,配制时选取量筒即可,故答案为:量筒;
②根据相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-,可以得出关系式:Cu2+
I3-,I2+2S2O32-=S4O62-+2I-,可以得出关系式:Cu2+![]() S2O32-,n(Cu2+)= n(S2O32-)=(0.1000×V×10-3)mol,则mg生成物中硫酸铜质量分数为:
S2O32-,n(Cu2+)= n(S2O32-)=(0.1000×V×10-3)mol,则mg生成物中硫酸铜质量分数为: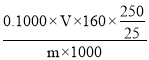 ×100%,故答案为:
×100%,故答案为: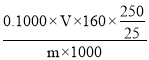 ×100%;
×100%;
③因为CuI沉淀对I3-具有强的吸附能力,会造成碘单质实际消耗量偏少,由此造成硫酸铜质量分数测定值偏小;根据氧化还原反应特点,可以得出碘单质与硫氰化钾之间的离子反应方程式为:SCN-+4I2+4H2O=SO42-+7I-+ICN+8H+,故答案为:SCN-+4I2+4H2O=SO42-+7I-+ICN+8H+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】AlN具有耐高温、导热性好等优点,可溶于浓的NaOH溶液。一定条件下可通过反应Al2O3+N2+3C=2AlN+3CO合成。下列叙述正确的是( )
A.反应中N2是还原剂
B.AlN可作耐高温材料
C.每生成1 mol AlN,有3mol电子转移
D.产物AlN中混有的Al2O3可用浓的NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体常用做农业和渔业的杀虫剂、杀菌剂。实验室模拟由废铜屑(含少量铁)生产硫酸铜晶体的流程如图:
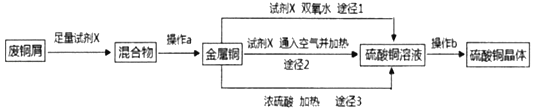
(1)试剂X是_____,操作a需要的玻璃仪器有烧杯、玻璃棒和_____。
(2)途径1是将铜加入到试剂X与双氧水的混和液中并用30~40℃水浴加热,该过程中温度不宜过高的原因是_____。
(3)途径2是将铜加入到试剂X中,再通入足量的空气并加热,该反应的化学方程式为_____。
(4)从环保和经济的角度对比途径1与途径3,途径1的优点有_____、_____。
(5)操作b包括蒸发浓缩、_____、过滤、冼涤、干燥(请补全缺少的实验步骤)。
(6)硫酸铜晶体(CuSO4xH2O)中结晶水数目可通过以下实验测定:
Ⅰ.称取4.6400g样品置于小烧杯中,加入适量水溶解,边搅拌边滴加BaCl2溶液到沉淀完全
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为4.6600g。计算CuSO4xH2O中的x值(要求写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
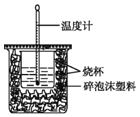
(1)该图中有一处未画出,它是_______填仪器名称)。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则根据此实验的数据书写中和热的热化学方程式中的H将____(填“偏大”“偏小”或“不变”),原因是_______。
(4)利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,设溶液的密度均为1 g/cm3,中和后溶液的比热容c=4.18 J/(g·℃),请根据实验数据计算中和热H= __ (取小数点后一位)。
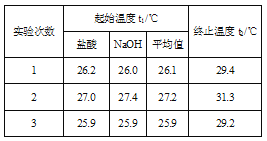
(5)上述(4)中的结果与中和热的理论值有偏差,产生偏差的原因可能是___。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程表达式中,属于电离方程式的是( )
A. HSO3-+H3O+![]() H2SO3+H2OB. NH3·H2O
H2SO3+H2OB. NH3·H2O![]() NH4++OH-
NH4++OH-
C. CH3COO-+H2O![]() CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
A.v(A)=0.5 mol·L1·min 1B.v(B)=0.1 mol·L1·s1
C.v(C)=0.8 mol·L1·min 1D.v(D)=1 mol·L1·min 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在反应:A(g)+3B(g)![]() 2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断正确的是
A. 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B. 图Ⅱ研究的是温度对反应的影响,且甲的温度较高
C. 图Ⅱ研究的是压强对反应的影响,且甲的压强较大
D. 图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物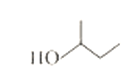 系统命名法命名为______________;2,3-二甲基-1-戊烯的结构简式____;
系统命名法命名为______________;2,3-二甲基-1-戊烯的结构简式____;
(2)写出甲苯制TNT的化学方程式:_________________
(3)写出1,2-二氯乙烷发生消去反应的方程式:___________
(4)下列卤代烃在强碱的醇溶液中加热不反应的有________________;
①![]() ②(CH3)3CCH2Cl ③(CH3)3CBr ④CHCl2CHBr2 ⑤
②(CH3)3CCH2Cl ③(CH3)3CBr ④CHCl2CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
(5)有机物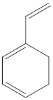 与等物质的量的Br2发生加成反应产物有_________种;
与等物质的量的Br2发生加成反应产物有_________种;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。

(1)①电源上b为___极
②Z槽中e为___极。
③连接Y、Z槽线路中,电子流动的方向是d___e(用“→”或“←”填空)。
(2)①写出Y槽中总反应的化学方程式:____。
②写出Z槽中e极上反应的电极反应式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com