
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NH4HCO3![]() NH3
NH3![]() NO
NO
B.N2![]() NO2
NO2![]() HNO3
HNO3
C.Al![]() Al(NO3)3(aq)
Al(NO3)3(aq)![]() Al(OH)3(aq)
Al(OH)3(aq)
D.S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
科目:高中化学 来源: 题型:
【题目】有以下物质①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩液态氯化氢。
(1)其中能导电的是_______;属于非电解质的是_________。
(2)等质量④和⑤中氢原子的数目之比为_____;若④和⑤中所含氢原子数相等,则④和⑤的质量之比为________。
(3)写出⑥和⑧在水溶液中的离子反应方程式____________________________。
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。
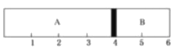
①A室混合气体所含分子总数约为______________(填数值)
②实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压下氢气密度的______倍。
③若将A室H2、O2的混合气体点燃,恢复原温度后,最终活塞停留的位置在______刻度处。
(5)在标准状况下,1L2mol/L氢氧化钠溶液中通入33.6L二氧化碳气体充分反应,所得溶液溶质的成分是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.近期,四川等地频频发生地震,在地震过后,常常喷洒各类消毒液对灾民临时生活区进行消毒。某品牌的“84消毒液”的主要成分为NaClO,浓度为![]() ,密度为
,密度为![]() 。
。
请回答下列问题:
(1)该“84消毒液”的质量分数为___(保留3位有效数字)。
(2)某同学欲用NaClO固体配制240mL“84消毒液”。
①下列仪器中,不需要用到的是___。
A.烧杯 B.250 mL容量瓶 C.10mL量筒 D.胶头滴管 E.天平
②下列操作会导致所得溶液浓度偏高的是_____。
A.用长时间放置在空气中的NaClO固体配制 B.配制前,容量瓶中有少量蒸馏水
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 D.定容时俯视容量瓶刻度线
Ⅱ.近年来,雾霾天气频繁发生,降低氮氧化物的排放,至关重要。
(3)三元催化剂能同时实现汽车尾气中的CO、![]() 、
、![]() 三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助傅里叶红外光谱图(如图2所示)确定。
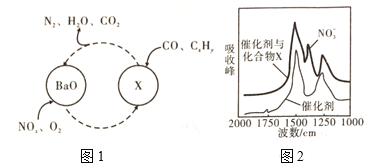
①X的化学式为____。
②在图1的转化中,既有被氧化又有被还原的元素是___(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2═NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油的开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子:![]() Cl
Cl
B.H2O的电子式:![]()
C.Na+的结构示意图:![]()
D.N2的结构式:N═N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将废弃锂离子电池再生处理,制Co3O4的工艺流程如图所示:
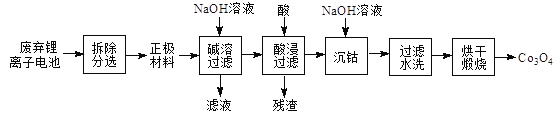
已知:锂离子电池正极材料是由活性材料(LiCoO2)、导电剂(炭黑)按一定比例粘附在铝箔上。Ksp[Co(OH)2]=1.6×10-15,本流程中完全沉淀时溶液中c(Co2+)≤1×10-6 mol/L。Co3+有强氧化性,易转化为+2价形态存在于水溶液中。
(1)锂离子电池工作时的总反应为6C+LiCoO2![]() Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
(2)常用H2SO4酸浸而不用盐酸,因为盐酸酸浸LiCoO2时会生成氯气,该反应的化学方程式为_____________。
(3)当Co(OH)2完全沉淀时,浸出液中应加NaOH溶液至c(OH-)≥__________________。
(4)检验Co(OH)2沉淀洗净的方法是________________________。
(5)在空气中加热Co(OH)2至290℃时已完全脱水,到1000℃时剩余固体的质量为Co(OH)2质量的80.65%。则剩余固体的成分为____________________(填化学式)。(Co:59 Co(OH)2式量:93 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40 ℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是
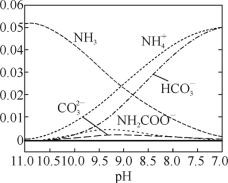
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 随着CO2的通入,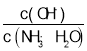 不断增大
不断增大
C. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
D. 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
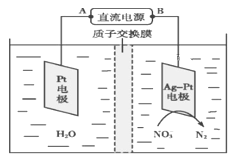
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。

请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:____________________________________。
(2)乙中X是_________交换膜,向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因______________________________________________
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为__________。
(4)欲用丙装置给铜镀银,b应是____________(填化学式)。
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。
①Ag-Pt电极上的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
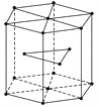
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为 _________________________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是______________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________________。
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为____________________。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com