
【题目】将废弃锂离子电池再生处理,制Co3O4的工艺流程如图所示:
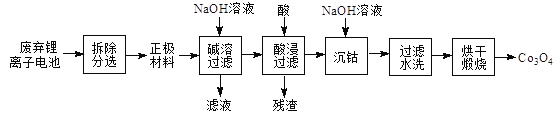
已知:锂离子电池正极材料是由活性材料(LiCoO2)、导电剂(炭黑)按一定比例粘附在铝箔上。Ksp[Co(OH)2]=1.6×10-15,本流程中完全沉淀时溶液中c(Co2+)≤1×10-6 mol/L。Co3+有强氧化性,易转化为+2价形态存在于水溶液中。
(1)锂离子电池工作时的总反应为6C+LiCoO2![]() Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
(2)常用H2SO4酸浸而不用盐酸,因为盐酸酸浸LiCoO2时会生成氯气,该反应的化学方程式为_____________。
(3)当Co(OH)2完全沉淀时,浸出液中应加NaOH溶液至c(OH-)≥__________________。
(4)检验Co(OH)2沉淀洗净的方法是________________________。
(5)在空气中加热Co(OH)2至290℃时已完全脱水,到1000℃时剩余固体的质量为Co(OH)2质量的80.65%。则剩余固体的成分为____________________(填化学式)。(Co:59 Co(OH)2式量:93 )
【答案】Li1-xCoO2 +xLi++xe- =LiCoO2 2LiCoO2+8HCl=2CoCl2+Cl2↑+2LiCl+4H2O 4×10-5 mol/L 取最后一次洗涤滤液于试管中,滴加盐酸酸化的氯化钡溶液,无白色沉淀产生 CoO
【解析】
(1)放电时正极发生还原反应,根据总反应方程式书写;
(2)盐酸与LiCoO2发生氧化还原反应产生Cl2、CoCl2、LiCl和水,根据电子转移数目相等可得反应方程式;
(3)根据溶度积常数的含义,结合Ksp[Co(OH)2]=1.6×10-15及溶液中c(Co2+)≤1×10-6 mol/L计算c(OH-);
(4) Co(OH)2沉淀是从含H2SO4的溶液中过滤出来的,若洗涤溶液中无SO42-,就证明沉淀洗涤干净;
(5)在灼烧过程中Co元素的质量不变,根据Co的质量分数,计算Co、O原子个数比,可得化学式。
(1)放电时正极发生还原反应,根据放电时的反应方程式可得正极的电极反应式为:Li1-xCoO2 +xLi++xe- =LiCoO2;
(2)盐酸与LiCoO2发生氧化还原反应产生Cl2、CoCl2、LiCl和水,根据电子转移数目相等可得反应方程式2LiCoO2+8HCl=2CoCl2+Cl2↑+2LiCl+4H2O;
(3) Ksp[Co(OH)2]= c(Co2+)·c2(OH-)=1.6×10-15;由于c(Co2+)≤1×10-6 mol/L,所以c(OH-)≥![]() =4.4×10-5mol/L;
=4.4×10-5mol/L;
(4)检验Co(OH)2沉淀洗净的方法是取最后一次洗涤滤液于试管中,滴加盐酸酸化的氯化钡溶液,无白色沉淀产生,证明洗涤溶液中无SO42-,则该沉淀洗涤干净了;
(5)根据质量守恒定律,在变化过程中,Co的质量没有变,假设原始固体质量为100g,则n(Co)=![]() mol;m(Co)=
mol;m(Co)=![]() ×59g,m(O)=(100g×80.65%)-
×59g,m(O)=(100g×80.65%)-![]() ×59g,则n(Co):n(O)=
×59g,则n(Co):n(O)=![]() mol:[
mol:[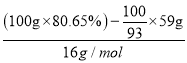 ]=1:1,所以该物质的化学式为CoO。
]=1:1,所以该物质的化学式为CoO。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产中应用广泛。
Ⅰ.某同学设计如下实验装置测定铜的相对原子质量(夹持和加热仪器已略去),并检验氯气的氧化性。
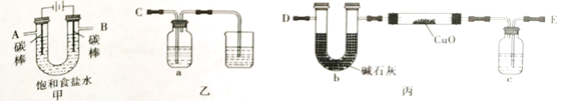
(1)该实验装置的连接顺序为:A连接________,B连接________(填字母)。
(2)乙装置a瓶中的溶液可以是_______
A.NaOH溶液 B.Na2S溶液 C.酸性KMnO4溶液 D.含少量KSCN的FeCl2溶液
(3)对丙装置进行加热前需要________ 。
(4)准确称量 m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为________ (只要求列出算式)。该实验方案的装置有不合理之处,若不加以改正会导致测定结果________(填“偏大”、”偏小“或”不变“)。
Ⅱ.研究发现Cu与稀盐酸不反应,但在持续通入空气的条件下可反应生成CuCl2。
(5)已知Fe3+对该反应有催化作用,其催化原理如图所示:
![]()
则图中的M‘为________(填化学符号)
(6)向CuCl2溶液中通入H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2++H2S=CuS(s)+2H+ , 则该反应的平衡常数K=________(保留一位小数)。已知:CuS溶度积KSP=1.0×10-36 , H2S电离常数Ka1=1.3×10-7 , Ka2=7.0×10-15。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. ![]() σ键和π键比例为7:1
σ键和π键比例为7:1
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C. C22﹣与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA, O22+的电子式可表示为 ![]()
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油画所用的颜料有许多天然矿石成分,矿石中往往含有B、C、O、Na、P、Cl等元素,它们在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+中碳原子的杂化方式为_________,CH3-的空间构型为_______。
(3) Na+和Ne互为等电子体,电离能I2(Na)______I1(Ne)(填“>”或“<”)。
(4)氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为__________,从原子结构分析影响ΔH2递变的因素为__________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子。已知晶胞中最近的B、P原子的距离为apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。(列出计算式即可,不必化简)
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置____。
画出B原子的投影位置____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NH4HCO3![]() NH3
NH3![]() NO
NO
B.N2![]() NO2
NO2![]() HNO3
HNO3
C.Al![]() Al(NO3)3(aq)
Al(NO3)3(aq)![]() Al(OH)3(aq)
Al(OH)3(aq)
D.S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
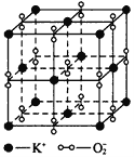
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
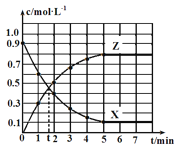
A. 2 min内,X的平均反应速率为0.25 mol·L-1·min-1
B. 第t min时,该反应达到平衡状态
C. 第5 min后,X的生成速率与Z的生成速率相等且保持不变
D. 5 min内,反应放出的热量为1.6Q kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com