
【题目】下列说法错误的是( )
A. ![]() σ键和π键比例为7:1
σ键和π键比例为7:1
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C. C22﹣与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA, O22+的电子式可表示为 ![]()
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为3NA
【答案】A
【解析】
A.单键全是σ键,双键中1个是σ键、一个是π键, ![]() 中σ键和π键比例为9:1,故A错误;
中σ键和π键比例为9:1,故A错误;
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,第三电离能突然增大,所以最外层有2个电子,当它与氯气反应时可能生成的阳离子是X2+,故B正确;
C. 等电子体结构相似,C22﹣与O22+互为等电子体,O22+的电子式可表示为 ![]() ,所以1 mol O22+中含有的π键数目为2NA,故C正确;
,所以1 mol O22+中含有的π键数目为2NA,故C正确;
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则生成1.5mol氮气,形成的π键数目为3NA,故D正确。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:Cu(OH)2+4NH3![]() [Cu(NH3)4]2+2OH-
[Cu(NH3)4]2+2OH-
平衡Ⅱ:Cu(OH)2+2OH-![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mg·L-1 | 72 | ≤0.5 |
Nh4+/mg·L-1 | 2632 | ≤15 |
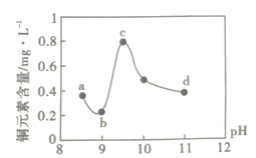
下列说法错误的是( )
A.a~b段发生的反应为:Cu2++2OH-=Cu(OH)2↓
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的5种短周期元素。A与D、C与E分别同主族,E原子的最外层电子数比次外层少2个。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。请回答下列问题:
(1)气体甲溶于水所得溶液呈碱性的原因(用电离方程式表示)______________。
已知:甲、乙、丙、丁4种物质之间的转化关系如下图(注:反应条件或产物已略去)。
甲![]() 乙
乙![]() 丙
丙![]() 丁
丁
请写出从甲→乙转化的化学方程式____________________________________________。
(2)用电子式表示离子化合物D2C2的形成过程____________________________________。
(3)DAEC3和DAEC4的溶液均呈现_______(填:“酸”“碱”“中”)性,在DAEB3溶液中离子浓度由大到小的顺序是________________________________;如果将两种溶液混合后发生反应的离子方程式为____________________________________。
(4)已知A2EC3和A2EC4两种酸中酸性更强的是后者,请从分子结构和性质的关系角度解释这种差异产生的原因___________________________________。
(5)B元素的三氯化物(BCl3)常温下是一种淡黄色液体,具有三角锥型的分子结构。下列关于BCl3分子的描述中不正确的是_________________。
A.BCl3分子中B显-3价、采用SP3杂化
B.BCl3分子间可形成氢键,比PCl3难挥发
C.B、C元素的电负性B< C ,第一电离能B>C
D.BCl3遇水发生水解反应产物是BH3和HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
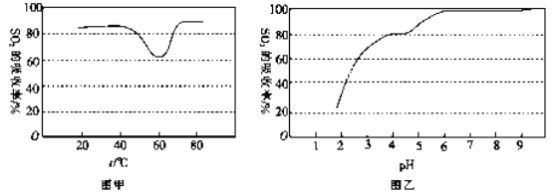
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
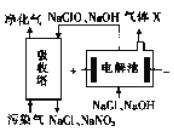
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.近期,四川等地频频发生地震,在地震过后,常常喷洒各类消毒液对灾民临时生活区进行消毒。某品牌的“84消毒液”的主要成分为NaClO,浓度为![]() ,密度为
,密度为![]() 。
。
请回答下列问题:
(1)该“84消毒液”的质量分数为___(保留3位有效数字)。
(2)某同学欲用NaClO固体配制240mL“84消毒液”。
①下列仪器中,不需要用到的是___。
A.烧杯 B.250 mL容量瓶 C.10mL量筒 D.胶头滴管 E.天平
②下列操作会导致所得溶液浓度偏高的是_____。
A.用长时间放置在空气中的NaClO固体配制 B.配制前,容量瓶中有少量蒸馏水
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 D.定容时俯视容量瓶刻度线
Ⅱ.近年来,雾霾天气频繁发生,降低氮氧化物的排放,至关重要。
(3)三元催化剂能同时实现汽车尾气中的CO、![]() 、
、![]() 三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助傅里叶红外光谱图(如图2所示)确定。
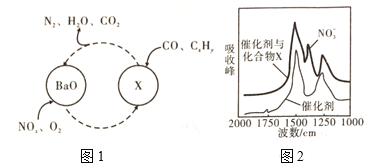
①X的化学式为____。
②在图1的转化中,既有被氧化又有被还原的元素是___(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某无色溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、AlO2-、CO32-、SO42-、I-、SiO32-,MnO4-中的N种离子组成。某化学兴趣小组通过下列实验确定了其组成:
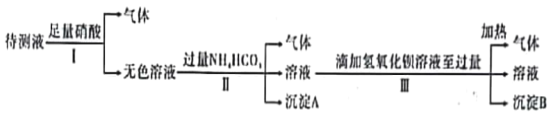
回答下列问题:
(1)不用做实验就可以肯定原溶液X中不存在的离子是_______________(填离子符号)。
(2)通过上述实验知,X溶液中一定存在__________种离子(填数字;不考虑H+、OH-)。
(3)在上述滴加氢氧化钡溶液过程中,开始阶段发生反应的离子方程式一定有_____________
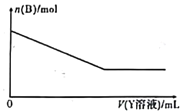
(4)该化学兴趣小组的同学为了进一步确定白色沉淀B的成分,取一定量经洗涤后的B与Y溶液反应,沉淀B的物质的量与Y溶液体积之间的关系如图所示。Y可能为____________。B的组成为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将废弃锂离子电池再生处理,制Co3O4的工艺流程如图所示:
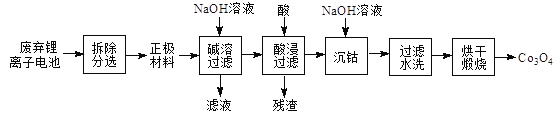
已知:锂离子电池正极材料是由活性材料(LiCoO2)、导电剂(炭黑)按一定比例粘附在铝箔上。Ksp[Co(OH)2]=1.6×10-15,本流程中完全沉淀时溶液中c(Co2+)≤1×10-6 mol/L。Co3+有强氧化性,易转化为+2价形态存在于水溶液中。
(1)锂离子电池工作时的总反应为6C+LiCoO2![]() Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
(2)常用H2SO4酸浸而不用盐酸,因为盐酸酸浸LiCoO2时会生成氯气,该反应的化学方程式为_____________。
(3)当Co(OH)2完全沉淀时,浸出液中应加NaOH溶液至c(OH-)≥__________________。
(4)检验Co(OH)2沉淀洗净的方法是________________________。
(5)在空气中加热Co(OH)2至290℃时已完全脱水,到1000℃时剩余固体的质量为Co(OH)2质量的80.65%。则剩余固体的成分为____________________(填化学式)。(Co:59 Co(OH)2式量:93 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com