
【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】有以下物质:①石墨;②水银;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧冰酷酸(CH3COOH);⑨氧化钠固体; ⑩液态氯化氢。
(1)其中能导电的是_________; 属于非电解质的是_________; 属于电解质的是____________
(2)等质量④和⑤中氢原子的数目之比为_____; 若④和⑤中所含氢原子数相等, 在相同条件下④和⑤的体积之比为____________
(3)向⑥中加入少量⑦请写出离子方程式:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产中应用广泛。
Ⅰ.某同学设计如下实验装置测定铜的相对原子质量(夹持和加热仪器已略去),并检验氯气的氧化性。
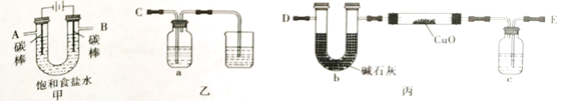
(1)该实验装置的连接顺序为:A连接________,B连接________(填字母)。
(2)乙装置a瓶中的溶液可以是_______
A.NaOH溶液 B.Na2S溶液 C.酸性KMnO4溶液 D.含少量KSCN的FeCl2溶液
(3)对丙装置进行加热前需要________ 。
(4)准确称量 m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为________ (只要求列出算式)。该实验方案的装置有不合理之处,若不加以改正会导致测定结果________(填“偏大”、”偏小“或”不变“)。
Ⅱ.研究发现Cu与稀盐酸不反应,但在持续通入空气的条件下可反应生成CuCl2。
(5)已知Fe3+对该反应有催化作用,其催化原理如图所示:
![]()
则图中的M‘为________(填化学符号)
(6)向CuCl2溶液中通入H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2++H2S=CuS(s)+2H+ , 则该反应的平衡常数K=________(保留一位小数)。已知:CuS溶度积KSP=1.0×10-36 , H2S电离常数Ka1=1.3×10-7 , Ka2=7.0×10-15。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了10种元素在元素周期表中的位置:
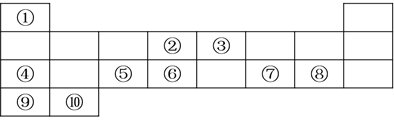
请用相应的化学用语回答下列问题:
(1)元素②在元素周期表中处于第________________周期,第________________族;
(2)上述10种元素中,金属性最强的元素的符号为________________,最高价氧化物对应水化物中,酸性最强的物质的分子式为________________;
(3)②、③、⑥三种元素按原子半径由大到小的顺序排列为________________(用元素符号表示);
(4)④在空气中燃烧的化学方程式为________________;
(5)元素④、⑦的最高价氧化物对应水化物发生反应的离子方程式为________________;
(6)⑧与⑨形成的化合物的电子式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氟利昂-12(CF2Cl2)是甲烷的氯、氟卤代物,它有2种同分异构体
B.对甲基苯甲醛(![]() )使高锰酸钾酸性溶液褪色,说明它含有醛基
)使高锰酸钾酸性溶液褪色,说明它含有醛基
C.溴水可以区分苯和乙酸
D.糖类是食物组成中的重要部分,也是产生能量最高的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. ![]() σ键和π键比例为7:1
σ键和π键比例为7:1
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C. C22﹣与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA, O22+的电子式可表示为 ![]()
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
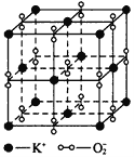
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com