
【题目】下表列出了10种元素在元素周期表中的位置:
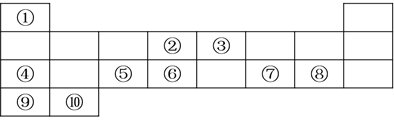
请用相应的化学用语回答下列问题:
(1)元素②在元素周期表中处于第________________周期,第________________族;
(2)上述10种元素中,金属性最强的元素的符号为________________,最高价氧化物对应水化物中,酸性最强的物质的分子式为________________;
(3)②、③、⑥三种元素按原子半径由大到小的顺序排列为________________(用元素符号表示);
(4)④在空气中燃烧的化学方程式为________________;
(5)元素④、⑦的最高价氧化物对应水化物发生反应的离子方程式为________________;
(6)⑧与⑨形成的化合物的电子式为________________。
【答案】二 IVA K HClO4 Si>C>N 2Na+O2![]() 2Na2O2 H++OH―=H2O
2Na2O2 H++OH―=H2O ![]()
【解析】
根据周期表可知①为H,②为C,③为N,④为Na,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为K,⑩为Ca;据此回答问题。
(1)元素②为C,是6号元素,位于周期表第二周期第IVA族;
(2)同周期从左向右金属性逐渐减弱,非金属性逐渐增强,同主族从上到下金属性逐渐增强,非金属性逐渐减弱,因此10种元素中,金属性最强的元素的符号为K,最高价氧化物对应水化物中,酸性最强的物质的分子式为HClO4;
(3)同周期从左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,因此C、N、Si三种元素的原子半径由大到小的顺序为:Si>C>N;
(4)④为Na,在空气中燃烧生成过氧化钠,反应方程式为:2Na+O2![]() Na2O2;
Na2O2;
(5)④的最高价氧化物对应的水化物为NaOH,⑦的最高价氧化物对应的水化物为H2SO4,二者反应的方程式为2NaOH+H2SO4=Na2SO4+2H2O,离子方程式为:H++OH-=H2O;
(6)⑧为Cl,⑨为K,二者构成的化合物为KCl,属于离子化合物,其电子式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.向Na2SiO3中通入过量CO2:Na2SiO3 +2CO2+2H2O![]() H2SiO3↓+2HCO3-+2Na+
H2SiO3↓+2HCO3-+2Na+
B.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
C.用热的NaOH溶液溶解S:3S+4OH- ![]() 2S2-+SO2↑+2H2O
2S2-+SO2↑+2H2O
D.酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+ ![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(1) 某学生在实验室用密度为1.9g/mL, 质量分数为15%的工业品过氧乙酸配制0.1mol/L过氧乙酸溶液250mL,该生用量筒量取工业品过氧乙酸体积_____mL,除量筒、玻璃棒、烧杯外还需要的其它仪器是_______________________
(2)该学生配制前设计了下列操作,其合理的操作顺序是___________(字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需体积的工业品过氧乙酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的工业品过氧乙酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,倒置并振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1- -2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高” 、‘“偏低”或“无影响”)
a.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水_________
b.转移溶液时,不慎有少量溶液洒在容量瓶外_________
c.量取15%的工业品过氧乙酸时,仰视量筒_________
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线________
(4)下列叙述正确的是__________________(填字母)

A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如上图所示
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩液态氯化氢。
(1)其中能导电的是_______;属于非电解质的是_________。
(2)等质量④和⑤中氢原子的数目之比为_____;若④和⑤中所含氢原子数相等,则④和⑤的质量之比为________。
(3)写出⑥和⑧在水溶液中的离子反应方程式____________________________。
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示。
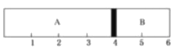
①A室混合气体所含分子总数约为______________(填数值)
②实验测得A室混合气体的质量为34g,则该混合气体的密度是同温同压下氢气密度的______倍。
③若将A室H2、O2的混合气体点燃,恢复原温度后,最终活塞停留的位置在______刻度处。
(5)在标准状况下,1L2mol/L氢氧化钠溶液中通入33.6L二氧化碳气体充分反应,所得溶液溶质的成分是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是
A. K+不一定存在 B. Ba2+、Mg2+不一定都存在
C. Cl-不一定存在 D. 混合溶液中CO32-的浓度为0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的5种短周期元素。A与D、C与E分别同主族,E原子的最外层电子数比次外层少2个。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。请回答下列问题:
(1)气体甲溶于水所得溶液呈碱性的原因(用电离方程式表示)______________。
已知:甲、乙、丙、丁4种物质之间的转化关系如下图(注:反应条件或产物已略去)。
甲![]() 乙
乙![]() 丙
丙![]() 丁
丁
请写出从甲→乙转化的化学方程式____________________________________________。
(2)用电子式表示离子化合物D2C2的形成过程____________________________________。
(3)DAEC3和DAEC4的溶液均呈现_______(填:“酸”“碱”“中”)性,在DAEB3溶液中离子浓度由大到小的顺序是________________________________;如果将两种溶液混合后发生反应的离子方程式为____________________________________。
(4)已知A2EC3和A2EC4两种酸中酸性更强的是后者,请从分子结构和性质的关系角度解释这种差异产生的原因___________________________________。
(5)B元素的三氯化物(BCl3)常温下是一种淡黄色液体,具有三角锥型的分子结构。下列关于BCl3分子的描述中不正确的是_________________。
A.BCl3分子中B显-3价、采用SP3杂化
B.BCl3分子间可形成氢键,比PCl3难挥发
C.B、C元素的电负性B< C ,第一电离能B>C
D.BCl3遇水发生水解反应产物是BH3和HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.近期,四川等地频频发生地震,在地震过后,常常喷洒各类消毒液对灾民临时生活区进行消毒。某品牌的“84消毒液”的主要成分为NaClO,浓度为![]() ,密度为
,密度为![]() 。
。
请回答下列问题:
(1)该“84消毒液”的质量分数为___(保留3位有效数字)。
(2)某同学欲用NaClO固体配制240mL“84消毒液”。
①下列仪器中,不需要用到的是___。
A.烧杯 B.250 mL容量瓶 C.10mL量筒 D.胶头滴管 E.天平
②下列操作会导致所得溶液浓度偏高的是_____。
A.用长时间放置在空气中的NaClO固体配制 B.配制前,容量瓶中有少量蒸馏水
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 D.定容时俯视容量瓶刻度线
Ⅱ.近年来,雾霾天气频繁发生,降低氮氧化物的排放,至关重要。
(3)三元催化剂能同时实现汽车尾气中的CO、![]() 、
、![]() 三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示。化合物X可借助傅里叶红外光谱图(如图2所示)确定。
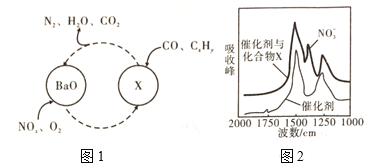
①X的化学式为____。
②在图1的转化中,既有被氧化又有被还原的元素是___(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。

请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:____________________________________。
(2)乙中X是_________交换膜,向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因______________________________________________
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为__________。
(4)欲用丙装置给铜镀银,b应是____________(填化学式)。
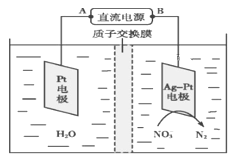
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。
①Ag-Pt电极上的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com