
【题目】下列离子方程式正确的是
A.向Na2SiO3中通入过量CO2:Na2SiO3 +2CO2+2H2O![]() H2SiO3↓+2HCO3-+2Na+
H2SiO3↓+2HCO3-+2Na+
B.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
C.用热的NaOH溶液溶解S:3S+4OH- ![]() 2S2-+SO2↑+2H2O
2S2-+SO2↑+2H2O
D.酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+ ![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.同温、同压下,相同质量的气体都占有相同的体积
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.同温、同压下,CH4与O2的密度之比1:2
D.由0.2gH2和8.8gCO2、5.6gCO组成混合气体,在标准状况下的体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化:
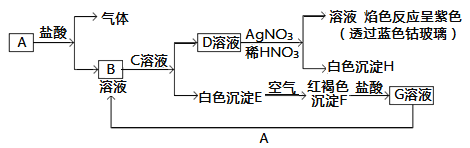
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式________________________。
(3)写出用KSCN鉴别G溶液的离子方程式________________;向G溶液加入A的有关离子反应方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊的药剂等。氨基钠(NaNH2)的熔点为210℃,沸点为400℃,在水溶液中易水解。实验室制取叠氮化钠的实验步骤及实验装置如下:
①打开止水夹K1,关闭止水夹K2,加热装置D一段时间;
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭K1;
③向装置A中b容器内加入加热介质并加热到210~220℃,打开止水夹K2,通入N2O;
④冷却,向产物中加入乙醇,减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
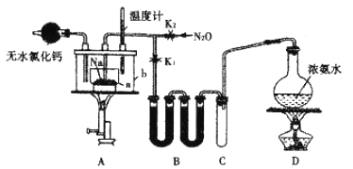
回答下列问题:
(1)装置B中盛放的药品为____________。
(2)氨气与熔化的钠反应生成NaNH2的化学方程式为__________。
(3)步骤③中,为了使反应受热均匀,A装置里a容器的加热方式为__________;生成NaN3的化学方程式为__________;N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则应选择的气体发生装置是_____________(填序号)。

(4)步骤④中用乙醚洗涤的主要目的是______________。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol/L(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+,则试样中NaN3的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙醇(C2H5OH)是未来内燃机的首选环保型液体燃料,它可以由绿色植物的秸秆制取,1.0g乙醇完全燃烧生成液态水放出1.367kJ热量,表示乙醇燃烧热的热化学方程式_____________。
(2)断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
化学键 | H-H | O=O | O-H |
E/kJ·mol-1 | 436 | x | 463 |
请回答下列问题:
①如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=__________(用含有a、b的关系式表示)。
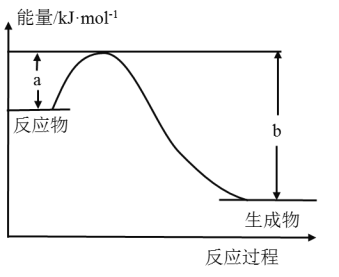
②若图示中表示反应H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ·mol-1,则b=_______kJ·mol-1,x=________。
O2(g)=H2O(g)ΔH=-241.8kJ·mol-1,则b=_______kJ·mol-1,x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______________________.
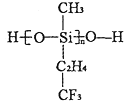
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为______杂化,在有机物中C原子间可以形成双键,而硅烷中Si原子间难以形成双键的原因是_____________.
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________(填元素符号)
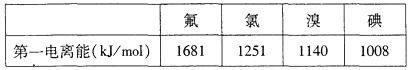
②根据价层电子对互斥理论,预测ClO的空间构型为___________形,写出一个ClO的等电子体的化学符号___________.
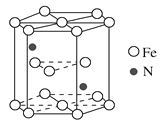
(4)海底金属软泥是在洋海底蕴藏着大量的资源,含有硅、铁、锰、锌等。某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为________________,若晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为________g·cm3(用含a、c和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子B. ClO3-的立体构型为平面三角形
C. NH3和BF3的立体构型均为平面三角形D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了10种元素在元素周期表中的位置:
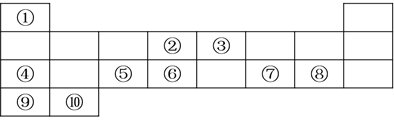
请用相应的化学用语回答下列问题:
(1)元素②在元素周期表中处于第________________周期,第________________族;
(2)上述10种元素中,金属性最强的元素的符号为________________,最高价氧化物对应水化物中,酸性最强的物质的分子式为________________;
(3)②、③、⑥三种元素按原子半径由大到小的顺序排列为________________(用元素符号表示);
(4)④在空气中燃烧的化学方程式为________________;
(5)元素④、⑦的最高价氧化物对应水化物发生反应的离子方程式为________________;
(6)⑧与⑨形成的化合物的电子式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com