
【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
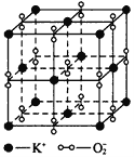
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。
【答案】AD NaCl 原子晶体 分子间作用力 GaAs 1s22s22p63s23p63d104s24p3或 [Ar]3d104s24p3 < GaF3为离子晶体,GaCl3为分子晶体
【解析】
I.A.根据平摊法,计算晶胞中K+与O2-个数;
B.由晶胞图可知,晶体中每个K+周围有6个O2-,每个O2-周围有6个K+;
C.由晶胞图可知,晶体中与每个K+距离最近的K+有12个;
D.结合晶胞中K+与O2-个数,根据电荷守恒判断;
II.根据A的水溶液与Ag+反应有白色沉淀,说明A的水溶液中有Cl-,再根据其可以导电得A为NaCl或HCl,又因为其硬度较大,所以判断其为NaCl;由于B的熔点很高、硬度很大、不导电、不溶于水,可判断其应该为原子晶体,所以B为金刚石;C的熔点为负、硬度很小,判断其为气体,易溶于水,水溶液与Ag+反应有白色沉淀,所以C为HCl,结合对应物质的组成和性质判断晶体的类型;
III. (1)由晶胞结构图可知,Ga位于体内,As位于顶点与面心,结合均摊法计算;
(2)As的原子序数为33;
(3)金属性越强,第一电离能越小;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,熔点不同与晶体类型有关。
I. A.由晶胞图可知,K+的个数为8×![]() +6×
+6×![]() =4,O2-的个数为12×
=4,O2-的个数为12×![]() +1=4,所以物质化学式为KO2,A正确;
+1=4,所以物质化学式为KO2,A正确;
B.由晶胞图可知,晶体中每个K+周围有6个O2-,每个O2-周围有6个K+,故B错误;
C.由晶胞图可知,晶体中与每个K+距离最近的K+有12个,故C错误;
D.晶胞中K+与O2-个数分别为4、4,所以晶胞中共有8个氧原子,根据电荷守恒-2价O原子数目为2,所以0价氧原子数目为8-2=6,所以晶体中,0价氧原子与-2价氧原子的数目比为3:1,D正确;
故合理选项是AD。
II.根据上述分析可知A为NaCl;B为金刚石;C为HCl。
(1)晶体A的化学式为NaCl;
(2)晶体B是金刚石,由于其熔点很高、硬度很大、不导电、不溶于水,故B为原子晶体;
(3)C是HCl,在固体时是由HCl分子构成的分子晶体,HCl分子之间存在分子间作用力;
III.(1)由晶胞结构图可知,Ga位于体内,个数为4,而As位于顶点与面心,个数为8×![]() +6×
+6×![]() =4,则砷化镓的化学式为GaAs;
=4,则砷化镓的化学式为GaAs;
(2)As的原子序数为33,基态As原子的核外电子排布式为[Ar]3d104s24p3;
(3)金属性越强,第一电离能越小,则第一电离能:Ga<As;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,离子间通过离子键结合,而GaCl3为分子晶体,分子之间通过分子间作用力结合,离子键是比分子间作用力强的作用力,因此断裂离子键消耗的能量比分子间作用力大,因此GaF3熔沸点比GaCl3高。


科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某无色溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、AlO2-、CO32-、SO42-、I-、SiO32-,MnO4-中的N种离子组成。某化学兴趣小组通过下列实验确定了其组成:
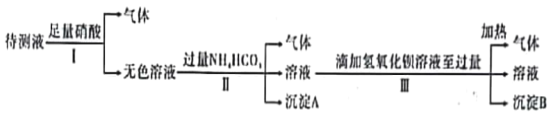
回答下列问题:
(1)不用做实验就可以肯定原溶液X中不存在的离子是_______________(填离子符号)。
(2)通过上述实验知,X溶液中一定存在__________种离子(填数字;不考虑H+、OH-)。
(3)在上述滴加氢氧化钡溶液过程中,开始阶段发生反应的离子方程式一定有_____________
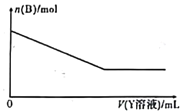
(4)该化学兴趣小组的同学为了进一步确定白色沉淀B的成分,取一定量经洗涤后的B与Y溶液反应,沉淀B的物质的量与Y溶液体积之间的关系如图所示。Y可能为____________。B的组成为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将废弃锂离子电池再生处理,制Co3O4的工艺流程如图所示:
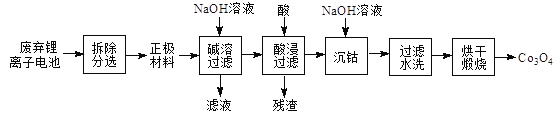
已知:锂离子电池正极材料是由活性材料(LiCoO2)、导电剂(炭黑)按一定比例粘附在铝箔上。Ksp[Co(OH)2]=1.6×10-15,本流程中完全沉淀时溶液中c(Co2+)≤1×10-6 mol/L。Co3+有强氧化性,易转化为+2价形态存在于水溶液中。
(1)锂离子电池工作时的总反应为6C+LiCoO2![]() Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
(2)常用H2SO4酸浸而不用盐酸,因为盐酸酸浸LiCoO2时会生成氯气,该反应的化学方程式为_____________。
(3)当Co(OH)2完全沉淀时,浸出液中应加NaOH溶液至c(OH-)≥__________________。
(4)检验Co(OH)2沉淀洗净的方法是________________________。
(5)在空气中加热Co(OH)2至290℃时已完全脱水,到1000℃时剩余固体的质量为Co(OH)2质量的80.65%。则剩余固体的成分为____________________(填化学式)。(Co:59 Co(OH)2式量:93 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。

请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:____________________________________。
(2)乙中X是_________交换膜,向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因______________________________________________
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为__________。
(4)欲用丙装置给铜镀银,b应是____________(填化学式)。
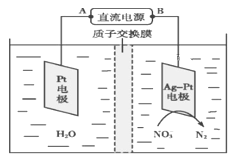
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。
①Ag-Pt电极上的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
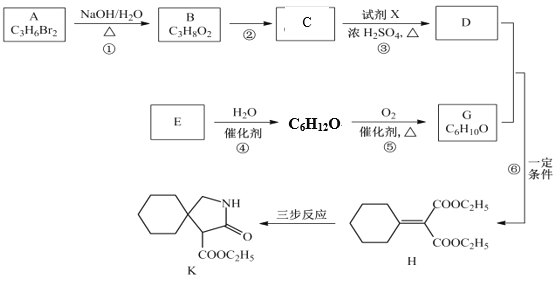
【题目】有机物K是某药物的前体,合成路线如图所示:
已知:R-CN ![]()
![]() ;
;
![]()
![]() +
+![]()
(1)B的结构简式是_____________。
(2)反应③的化学方程式是__________________。
(3)E属于烃,其分子式是_________________。
(4)H中含氧官能团的名称是_________________。
(5)写出满足下列条件的 K的一种同分异构体的结构简式:________________________
①遇氯化铁溶液显紫色; ②不含醚键; ③核磁共振氢谱显示峰面积之比为2:12:2:2:1
(6)H经三步反应合成K,写出J→K的化学方程式_____________________________。
![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. NaHCO3溶液的物质的量浓度为0.8 mol/L
B. b点与c点溶液所含微粒种类相同
C. a点溶液中存在的离子是Na+、AlO2-、OH-、H+
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O === Al(OH)3↓+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com