
【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D
【答案】B
【解析】
A.向平衡后的容器中充入惰性气体He,不能影响任何物质的浓度,因此对化学平衡移动无影响,A错误;
B.依据平衡三段式计算
2SO3(g)![]() 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
起始量 1 0 0
变化量 0.2 0.2 0.1 19.6
平衡量 0.8 0.2 0.1
起始时向容器中充入1.0molSO2和0.50molO2,反应达到相同平衡,反应的二氧化硫物质的量为0.8mol,放热196kJ×0.4=78.4kJ,B正确;
C.充入2.0molSO3、0.50mol SO2和0.25mol O2转化为起始量相当于充入2.5molSO3,相当于将相同的平衡叠加,由于该反应的正反应是气体体积增大的反应,增大压强,平衡逆向进行,反应达到平衡前v(正)<v(逆);C错误;
D.对于同一化学反应,平衡常数只与温度有关,温度不变,化学平衡常数不变,依据A计算平衡常数K=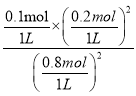 =
=![]() ;
;
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ/mol平衡常数K=160,
2SO3(g) △H=-196kJ/mol平衡常数K=160,
假设按照转化率为80%计算平衡常数分析,反应的二氧化硫为2mol
2SO2(g) + O2(g)![]() 2SO3(g)
2SO3(g)
起始量 2.5 1.25 0
变化量 2.5×0.8=2 1 2
平衡量 0.5 0.25 2
K=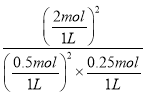 =64,不符合平衡常数,D错误;
=64,不符合平衡常数,D错误;
故合理选项是B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某离子晶体的晶胞示意图如下图所示,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,晶体的密度为d g·cm-3。
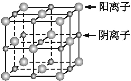
下列说法中正确的是
A. 晶体晶胞中阴、阳离子的个数都为1
B. 晶体中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为M/d cm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油画所用的颜料有许多天然矿石成分,矿石中往往含有B、C、O、Na、P、Cl等元素,它们在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+中碳原子的杂化方式为_________,CH3-的空间构型为_______。
(3) Na+和Ne互为等电子体,电离能I2(Na)______I1(Ne)(填“>”或“<”)。
(4)氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为__________,从原子结构分析影响ΔH2递变的因素为__________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子。已知晶胞中最近的B、P原子的距离为apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。(列出计算式即可,不必化简)
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置____。
画出B原子的投影位置____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 硫化钠的水解反应:S2-+H3O+![]() HS-+H2O
HS-+H2O
B. 用铜作阳极电解氯化铜溶液:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
C. Na2CO3溶液呈碱性的原因:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
D. 在Ba(OH)2溶液中滴加KHSO4溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
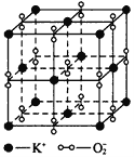
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是__________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2溶液和0.1 mol·L-1NH4HSO4溶液中的c(![]() ),前者_____后者。(填“等于”、“大于”或“小于”)
),前者_____后者。(填“等于”、“大于”或“小于”)
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
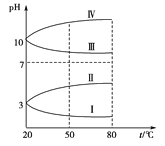
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_______ (填字母),导致pH随温度变化的原因是__________________;
②20 ℃时,0.1 mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=____________。
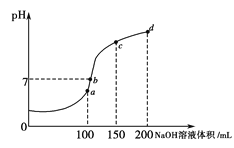
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________点;在b点,溶液中各离子浓度由大到小的排列顺序是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
2C(s) +O2(g) =2CO (g) △H2则△H1<△H2
A.已知2SO2(g)+O2![]() 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)==C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s) +2O2(g) =2 CO2(g)△H1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态价电子排布图为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com